
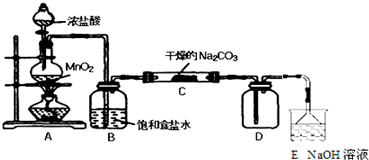
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
分析 ①氯气和碳酸钠反应生成碳酸氢钠和氯化钠、氯的氧化物;
②步骤2、碳酸根离子能和氯化钡反应生成碳酸钡沉淀;
步骤3、向溶液中加入澄清石灰水,如果溶液变浑浊,说明含有碳酸氢钠;
步骤4、氯离子和硝酸酸化的硝酸银溶液反应生成氯化银白色沉淀.
解答 解:①氯气和碳酸钠反应中生成氯的氧化物,则氯元素失电子化合价升高,还需要得电子化合价降低,所以还生成NaCl,所以固体中一定含有NaCl,故答案为:NaCl;
故答案为:NaCl;
②步骤2中,加入氯化钡溶液,钡离子和碳酸根离子反应生成碳酸钡白色沉淀,如果溶液变浑浊,说明溶液中含有Na2CO3,
步骤3中,取甲试管中上层清液少许于另一只试管中,滴加少量澄清石灰水,如果上层溶液变浑浊,说明固体中可溶性物质和氢氧化钙发生复分解反应,步骤2中去除碳酸根离子,所以证明固体中含有碳酸氢钠;
步骤4中,先加入过量的稀HNO3,再滴入少量AgNO3溶液,如果产生白色沉淀,则溶液中一定含有氯化钠,
故答案为:
| 步骤2: | Na2CO3 |
| 澄清石灰水 | 上层清液变浑浊 |
| 稀HNO3 AgNO3溶液 | 氯化钠 |
点评 本题采用实验探究的方法考查物质的组成,侧重考查分析、推断能力,明确实验原理是解本题关键,知道常见离子的检验方法,会根据氧化还原反应特点、元素守恒判断生成物,题目难度中等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl3+2H2O
+3FeCl3+2H2O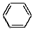 +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.| 温度 | 250℃ | 300℃ | 350℃ |
| A | 2.041 | 0.250 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.
.常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.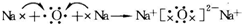 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
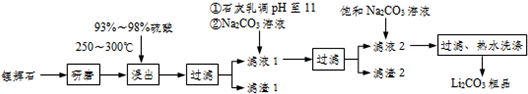
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  点燃酒精灯 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. |  制备氢气并检验H2的可燃性 | |
| D. | 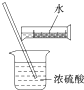 配制硫酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com