
【题目】不锈钢主要是由铁、镍、铜、碳等元素所组成的合金。具有优异的抗腐蚀性能。
(1)铁元素在周期表中的位置是________________,其基态原子的价电子排布图为___________________,基态三价阳离子最外层有________种运动状态不同的电子。
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,Ni(CO)n晶体属于___(填晶体类型)。写出一个与Ni(CO)n中配体互为等电子体的离子的化学式为___________。
(3)已知铜晶体为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则铜晶体的密度为________________g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。若铜的原子半径为r cm ,则在铜晶胞中用r表示出这种堆积模型的空间利用率为_________(保留两位小数)。
(4)邻羟基苯甲酸(又名水杨酸,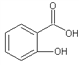 )和对羟基苯甲酸(
)和对羟基苯甲酸(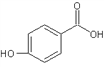 )都是二元酸。二者沸点相差较大的理由是_______________________________。已知苯酚(
)都是二元酸。二者沸点相差较大的理由是_______________________________。已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”)。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”)。
【答案】第四周期第Ⅷ族![]() 13分子晶体CN-(C22- 、O22+)256/a3NA0.74对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键,所以前者沸点高于后者<
13分子晶体CN-(C22- 、O22+)256/a3NA0.74对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键,所以前者沸点高于后者<
【解析】
试题(1)铁基态原子电子排布式为1s22s22p63s23p63d64s2,铁的外围电子排布是3d64s2;基态三价阳离子电子排布式为1s22s22p63s23p63d5,最外层有13个电子;(2)根据Ni(CO)n是易挥发液体分析;Ni(CO)n中配体是CO,等电子体是原子数相同、价电子数相同的微粒;(3)铜晶体为面心立方最密堆积,则1个晶胞含有铜原子数是![]() ;铜晶体为面心立方最密堆积,若铜的原子半径为r cm ,则晶胞边长为
;铜晶体为面心立方最密堆积,若铜的原子半径为r cm ,则晶胞边长为![]() cm 。(4)对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键;
cm 。(4)对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键;![]() 中形成分子内氢键,使该微粒中酚羟基更难电离出H+;
中形成分子内氢键,使该微粒中酚羟基更难电离出H+;
解析:(1)铁基态原子电子排布式为1s22s22p63s23p63d64s2,铁在周期表中的位置是第四周期第Ⅷ族,铁的价电子排布图为3d64s2;基态三价阳离子电子排布式为1s22s22p63s23p63d5,最外层有13个电子,所以最外层有13种运动状态不同的电子;(2)Ni(CO)n是易挥发液体,说明熔点低,属于分子晶体;Ni(CO)n中配体是CO,其等电子体是CN-或C22-;(3)铜晶体为面心立方最密堆积,则1个晶胞含有铜原子数是![]() ;一个晶胞的边长为a cm,晶胞的体积为
;一个晶胞的边长为a cm,晶胞的体积为![]() ,则铜晶体的密度为
,则铜晶体的密度为![]() g/cm3;若铜的原子半径为r cm ,则晶胞边长为
g/cm3;若铜的原子半径为r cm ,则晶胞边长为![]() cm,晶胞的体积是
cm,晶胞的体积是![]() ,1个晶胞含有4个铜原子, 4个铜原子的体积是
,1个晶胞含有4个铜原子, 4个铜原子的体积是![]() ,这种堆积模型的空间利用率为
,这种堆积模型的空间利用率为![]()
![]()
![]() =0.74;(4)对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键,所以所以前者沸点高于后者;
=0.74;(4)对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键,所以所以前者沸点高于后者;![]() 中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)。
中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO和足量C发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是

A. 增大压强或升高温度,NO转化率均增大
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源。实验室常用下列装置(夹持装置已略去)制备无水NiCl2。
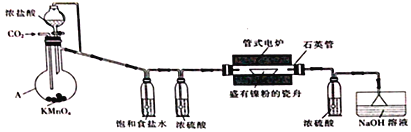
实验步骤如下:
I.按图示连接好装置,检查装置气密性后,先向装置中通入干燥的CO2。
II.约20min后,停止通入CO2,改为通儒Cl2并使装置中充满Cl2。
III.将电炉升温至750℃,在氯气流中加热约lh。
IV.在氯气流中冷却至室温后,再继续通入CO2约10min。
回答下列问题:
(1)仪器A的名称为_____________________________。
(2)步骤I中通入CO2的目的是___________________________。
(3)A中生成Cl2的离子方程式为______________________________________。
(4)判断步骤II中氧气已充满装置的现象是______________________________________。
(5)步骤IV中通入CO2的目的是______________,水槽中NaOH溶液的作用是_____________________。
(6)反应前石英管及瓷舟的总质量为m1、放入镍粉后石英管及瓷舟的总质量为m2,氧化反应后石英管及瓷舟的总质量为m3,则产品中n(Ni)/n(Cl)=________(填计算表达式)。
(7)实验室也可用NiCl2·6H2O与液态SOCl2混合加热制取无水NiCl2,其反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是

A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶金工业中,从冶铅废渣中再提取铅的工艺流程如下:
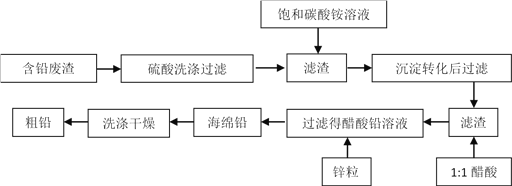
已知:Ksp (PbSO4) =1.6×10 -8;Ksp (PbCO3) =8.0×10 -14;醋酸铅易溶于水,难电离。
回答下列问题:
(1)此化工工艺达到了以下哪些目的:______________
A.减少环境污染 B.提高资源利用率 C.制备醋酸铅 D.制备了纯铅
(2)硫酸洗涤后,生成的PbSO4表面常含有铜单质,为溶解铜,常需要同时加入一定量的H2O2溶液,写出溶解铜的离子方程式:_________________________________;为加快此反应的速率,下列方法合适的是:_____________。
A.搅拌 B.适当加热 C.减压 D.将PbSO4固体粉碎
(3)加入碳酸铵溶液后PbSO4转化为PbCO3。转化的方程式为:PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq),通过计算,说明该反应能进行的原因:_________________________。这一步骤中,也可以将碳酸铵改用碳酸氢铵,但实际生产效果不好,请说明其中的一个原因:______________________________________________________。
(4)处理含铅废渣1000g(含铅以PbSO4计,质量分数为0.303),若回收率为 95% 。经原子吸收分光光度法及 EDTA 滴定法测定,产品(粗铅)纯度为 90%。则得到的粗铅质量为(保留一位小数)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
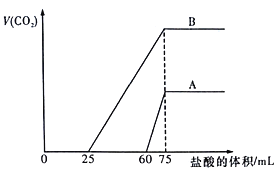
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验 (装置如图1所示),并用中和滴定实验测定所得氨水的浓度。
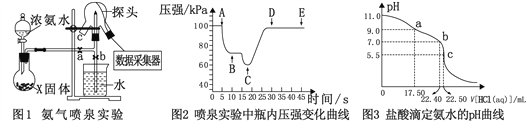
Ⅰ. 用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中X固体可以是_______________。
(2)关闭a,将吸有2 mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。则AB段压强变化的原因是__________。
Ⅱ. 室温下,用盐酸滴定得到的氨水,测定氨水的浓度。
(3)从三颈瓶中用______________(填仪器名称)量取25.00 mL氨水至锥形瓶中,用0.050 mol·L-1 盐酸滴定。用pH计采集数据、电脑绘制滴定曲线(图3)。则:
①该滴定的终点为_____________(填“a”、“b”或“c”);
②b点对应的溶液中,c(NH4+) _______ c(Cl-) (填“>”、“<”或“=”);
③据图,计算氨水的浓度为___________。
(4)该滴定实验中,若酸式滴定管未用盐酸润洗会导致测得氨水的浓度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L CCl4中含有的分子总数为0.1NA
B. 78 g Na2O2中含有的阴离子数为NA
C. 金属钠与水反应,生成22.4L氢气时,转移的电子数为2NA
D. 将含有1mol溶质的FeCl3溶液加入沸水中制取Fe(OH)3胶体,其含Fe(OH)3胶粒数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com