

分析 (1)X为H2S,H2S在空气中变浑浊是因为被氧气氧化为S;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
(3)分析反应中各元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(4)硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,反应速率越快,出现浑浊时间越短;
(5)②反应每得到1mol硫,放出270kJ的热量,以此书写热化学方程式;
③反应达到平衡状态时正逆反应速率相等,各组分浓度保持不变,据此分析;利用三段式法计算二氧化硫的转化率;
(6)由图可知,相同条件下铝钒土作催化剂时,二氧化硫的转化率最大.
解答 解:(1)X为H2S,H2S在空气中变浑浊是因为被氧气氧化为S,反应的化学方程式为2H2S+O2=2S↓+2H2O,故答案为:2H2S+O2=2S↓+2H2O;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,bd符合题意,
故答案为:bd;
(3)由原子和元素守恒可知,缺项为水,反应中S元素的化合价由+6价降低为+4价,S元素的化合价由0升高为+4价,结合电子、原子守恒可知反应为4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2K2SO4+2Al2O3+9SO2↑+48H2O,故答案为:4;3;2;2;9;48H2O;
(4)根据硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,
故答案为:b;
(5)②反应每得到1mol硫,放出270kJ的热量,热化学方程式为2CO(g)+SO2(g)$\frac{\underline{\;铝矾土\;}}{380℃}$S(l)+2CO2 (g)△H=-270kJ/mol,
故答案为:2CO(g)+SO2(g)$\frac{\underline{\;铝矾土\;}}{380}$S(l)+2CO2 (g)△H=-270kJ/mol;
③a、CO和SO2的速率之比始终等于化学计量数之比,其无法判断反应是否达到平衡状态,故a错误;
b、温度不变平衡常数始终不变,平衡常数不变不能说明反应达到平衡状态,故b错误;
c、容器体积不变,S为固态,反应正向进行气体体积减小,当气体质量不变时,说明各组分浓度不变,反应达到平衡状态,故c正确;
d、CO2和SO2的体积比保持不变说明正逆反应速率相等,反应达到平衡状态,故d正确;
由 2CO(g)+SO2 (g)═S(s)+2CO2(g)
反应前(mol) 4 1 0 0
转化了(mol)2x x x 2x
平衡后(mol)4-2x 1-x x 2x
混合气体中CO的体积分数为$\frac{7}{11}$,则有$\frac{4-2x}{4-2x+1-x+2x}$=$\frac{7}{11}$,x=0.6,
所以SO2的转化率为$\frac{0.6}{1}$×100%=60%,
故答案为:cd;60%.
(6)由图可知,生产中选铝钒土做催化剂的主要原因是铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小,
故答案为:铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小.
点评 本题为综合题,涉及非金属性比较、氧化还原反应、反应速率及热化学方程式等,侧重反应原理中高频考点的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①=②=③=④ | B. | ③>②>①>④ | C. | ④>②>①>③ | D. | ③>①>②>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | NH3具有碱性 | NH3极易溶于水 |
| C | 浓硫酸有吸水性 | 用浓硫酸干燥SO2 |
| D | HNO3具有酸性 | 可用铁和稀HNO3制取氢气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

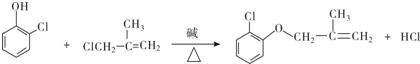 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).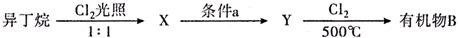
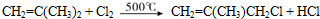 ;
;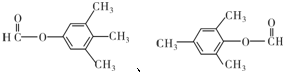
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产品中有被蒸馏出的H2SO4 | B. | 有部分未反应的乙醇被蒸馏出来 | ||
| C. | 有部分未反应的乙酸被蒸馏出来 | D. | 有部分乙醇跟浓硫酸作用生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④ | C. | ②③⑤ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
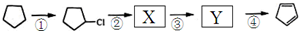

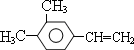 (任写一种).金刚烷与四氢二聚环戊二烯的关系是B.(填字母)
(任写一种).金刚烷与四氢二聚环戊二烯的关系是B.(填字母)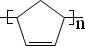 ..
.. .请写出下列反应的有机产物的结构简式:
.请写出下列反应的有机产物的结构简式: OHC-CHO、OHC-CH2-CHO.
OHC-CHO、OHC-CH2-CHO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )| A. | 镁比铝活泼,镁失去电子被氧化成Mg2+ | |
| B. | 铝是电池负极,开始工作时溶液中会立即有白色沉淀生成 | |
| C. | 该装置的内、外电路中,均是电子的定向移动形成电流 | |
| D. | 该装置开始工作时,铝片表面的氧化膜可不必处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com