
(3分)下列有关实验的叙述中,正确的是
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.用分液的方法分离水和酒精的混合物
C.配制1L0.1mol/L的NaCl溶液时可用托盘天平称量5.85gNaCl固体
D.用滴管滴加液体时,为防止液滴飞溅,滴管紧贴试管内壁
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:选择题
下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2 ↑
C.表示乙炔“燃烧热”对应的热化学方程式:C2H2(g)+ O2(g)=2CO2(g)+H2O(g) ?△H=-1 256 kJ/mol
O2(g)=2CO2(g)+H2O(g) ?△H=-1 256 kJ/mol
D.M与N是同素异形体,由M=N △H=+119 kJ/mol可知,N比M稳定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:实验题
(6分)某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发。为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验。请回答相关问题。
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,现有下列三种硫酸溶液,应选用 (填字母)。
A.98%浓硫酸 B.70%硫酸 C.10%稀硫酸
(2)为了探究SO2能否使品红褪色,该同学选择了正确的药品后设计了如下图所示实验装置,请指出实验装置设计中的不合理之处。

① ;② 。
(3)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。为此,你认为使品红的水溶液褪色的微粒可能是 。
(4)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出的结论:使品红褪色的微粒肯定是HSO3-或SO32-。你认为他的结论是否正确 ,其理由是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
为了探索外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。
cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。

下列判断正确的是
A.ΔH>0 a+b>c B.ΔH<0 a+b<c
C.ΔH<0 a+b>c D.ΔH>0 a+b<c
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
(9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
① ; ② ;
③ ; ④ 。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。
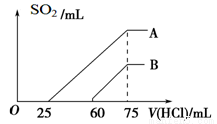
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是____mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为________ ____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
对下列化学用语的理解正确的是
A.原子结构示意图 :可以表示12C,也可以表示14C
:可以表示12C,也可以表示14C
B.比例模型 :可以表示二氧化碳分子,也可以表示水分子
:可以表示二氧化碳分子,也可以表示水分子
C.电子式: 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
D.分子式C2H4O2:可以表示乙酸,也可以表示乙二醇
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:填空题
(15分)开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。

回答下列问题:
(1)反应②的化学方程式为 。
(2)反应④的离子方程式为 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 (填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为 。
③若该天然气中硫化氢的体积分数为5%,且甲烷与水蒸气反应转化成二氧化碳和氢气的总转化率为80%,则通过上述流程1.00 m3 天然气理论上可制得氢气 m3(同温同压条件下)。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(生成的有机物为气体,忽略其他有机物)。
①生成目标产物的电极反应式为 。
②该储氢装置的电流效率为η= 。(η=  ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)

查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等五校高三联考理综化学试卷(解析版) 题型:填空题
(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:

已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42- (aq) △H>0
PbCl42- (aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为 ,步骤Ⅰ中另一个反应是H2O2与FeCl2、盐酸反应生成FeCl3,实现FeCl3的重复利用,其离子方程式为 ,加入盐酸的另一个目的是为了控制pH在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)滤液3是 。
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com