
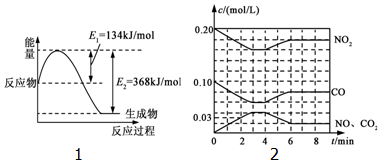
 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.分析 (1)由图1可得热化学方程式:①2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=2×[-(368-134)KJ/mol]=-468KJ/mol;
已知:②N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
③2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
根据盖斯定律,(③+①-②)可得:2NO(g)+2CO(g)?N2(g)+2CO2(g),焓变也进行相应的计算;
(2)①依据化学平衡移动原理,反应的特征分析判断选项中平衡影响因素和反应速率影响因素;
②依据图象数据分析计算;
③图象分析判断4min后反应物浓度增大,生成物浓度减小,说明平衡逆向进行,反应是放热反应,升温改变符合图象变化;
④依据图象读出平衡浓度,结合平衡常数概念计算平衡常数,再加入物质浓度,可以利用浓度商计算和平衡常数比较判断反应进行的方向.
解答 解:(1)由图1可得热化学方程式:①2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=2×[-(368-134)KJ/mol]=-468KJ/mol;
已知:②N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
③2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
根据盖斯定律,(③+①-②)可得:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-112.3kJ/mol-468kJ/mol-112.3=-759.8KJ/mol,
故答案为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol;
(2)图象分析可知反应为:NO2(g)+CO(g)?NO(g)+CO2(g)
①a.反应前后气体体积不变,当容器内的压强不发生变化,不能说明该反应达到平衡,故a错误;
b.当向容器中加再充入0.20mol NO时,平衡向逆反应方向移动,K值不变,故b错误;
c.升高温度后,K值减小,说明平衡逆向进行,NO2的转化率减小,故c正确;
d.向该容器内充入He气,总压增大,气体分压不变,所以反应反应速率不变,故d错误;
故选c;
②产物NO2在0~2min时平均反应速率v(NO2)=$\frac{0.2mol/L-0.17mol/L}{2min}$=0.015mol/L•min,
故答案为:0.015;
③图象分析可知4min后二氧化氮和一氧化碳浓度增大,一氧化氮和二氧化碳浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化;故答案为:升温;
④依据图象分析,6min时平衡状态下物质的浓度为c(NO2)=0.18mol/L,c(CO)=0.08mol/L,c(NO)=0.02mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,NO2(g)+CO(g)?NO(g)+CO2(g),K=$\frac{0.02×0.02}{0.18×0.08}$=$\frac{1}{36}$;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=$\frac{0.02×0.08}{0.18×0.10}$=$\frac{4}{45}$>K,平衡逆向进行,
故答案为:$\frac{1}{36}$;逆向.
点评 本题考查了热化学方程式和盖斯定律计算应用,化学平衡影响因素分析,平衡常数计算应用,需要学生具备扎实的基础,题目难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
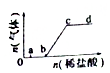 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| C. | c点对应的溶被中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入甲基橙显红色的溶液中:Al3+、NH4+、SO42-、MnO4- | |
| B. | 在酸性KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)•c(OH-)=10-20 mol2•L-2的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的热稳定性:H2T<H2R | |
| B. | 单质与稀盐酸反应的速率:L<Q | |
| C. | 离子半径:R2-<L2+ | |
| D. | M与T形成的化合物既能与强酸反应,又能与强碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com