
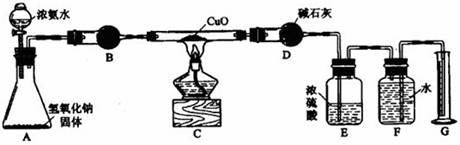
 N2+3Cu+3H2O (2分)
N2+3Cu+3H2O (2分) N2+3Cu+3H2O
N2+3Cu+3H2O NH3·H2O
NH3·H2O NH3+H2O
NH3+H2O NH3↑+H2O
NH3↑+H2O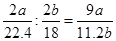


科目:高中化学 来源:不详 题型:填空题
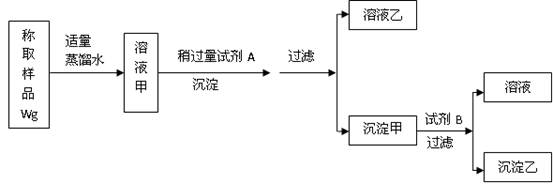
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 混合物 | 试剂 | 分离方法 |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 溴苯(溴单质) | 苯 | 萃取 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
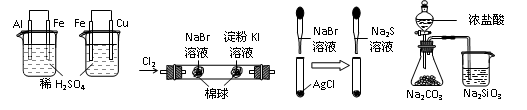
| 实 验 | 实验现象 | 结 论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性 :AgCl>AgBr>Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
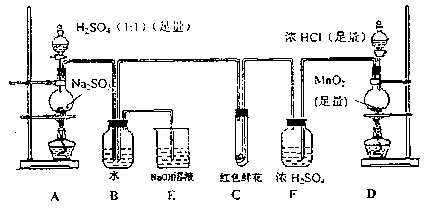
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
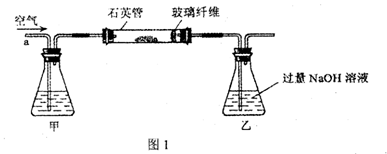
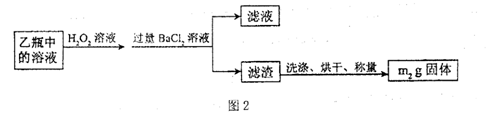
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com