
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,该反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
回答下列问题:
(1)0~5min时间内用H2表示的化学反应速率为___mol/(L·min)。
(2)达平衡时CH4的物质的量分数为___,CO2的转化率是___。
(3)反应前后混合气体的压强之比为___。
(4)为了加快反应速率,可采取什么措施___(写两条)。
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | CH4 | CO2 | CO | H2 |
能量/kJ | 1660 | 1490 | 1072 | 436 |
该催化重整反应中反应物的总能量___生成物的总能量(填“大于”或“小于”)。
(6)下列能表示该反应已经达到化学平衡状态的是___。
A.v逆(CH4)=2v正(CO)
B.CO2的浓度保持恒定
C.混合气体平均相对分子质量不变
D.混合气体密度保持不变
【答案】0.1 37.5% 50% 3:4 升高温度、缩小容器体积(或增大反应物浓度) 小于 BC
【解析】
反应速率之比等于反应系数之比,根据反应方程式的三段式计算平衡时物质的量和转化率;根据有效碰撞理论判断加快反应速率方法,根据平衡“逆等动定变”特征判断达到平衡状态。
(1)设反应到达平衡状态时,反应消耗的甲烷有xmol:
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
反应前 2mol 1mol 0 0
变化量 x x 1 1
平衡时 2-x 1-x 1 1
0~5min时间内用H2表示的化学反应速率为![]() =0.1mol/(L·min)。
=0.1mol/(L·min)。
(2)根据三段式可知,x=0.5mol,达平衡时CH4的物质的量为1.5mol,甲烷的物质的量分数为![]() ,CO2的转化率是
,CO2的转化率是![]() 。
。
(3)反应前后混合气体的压强之比与物质的量之比相等,即为3:4。
(4)根据有效碰撞理论理论,为了加快反应速率,可采取措施为:升高温度、缩小容器体积(或增大反应物浓度)等。
(5)该催化重整反应中反应物的总键能为1660 kJ +1490 kJ =3150kJ,生成物的总键能为2×(1072 kJ +436 kJ )=3016kJ,反应热=生成物总能量-反应物总能量=反应物总键能-生成物总键能>0,即反应物的总能量小于生成物的总能量。
(6)A. 反应速率之比等于反应系数之比,v逆(CH4)= 0.5v逆(CO),当v逆(CO)=v正(CO),即2v逆(CH4)= v正(CO)时,反应才到达平衡,A错误;
B.CO2的浓度保持恒定,反应达到平衡,B正确;
C.混合气体总质量不变,反应前后气体的总量发生变化,当平均相对分子质量不变时,反应达到平衡,C正确;
D. 混合气体总质量不变,装置为恒容状态,体积不变,故混合气体密度一直保持不变,不能判断平衡状态,D错误;
能表示该反应已经达到化学平衡状态的是BC。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mL1mol/LNH2OH![]() 溶液中加水进行稀释,所得曲线如图所示V表示溶液的体积
溶液中加水进行稀释,所得曲线如图所示V表示溶液的体积![]() ,
,![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()

A.![]() 的电离平衡常数Kb的数量级为
的电离平衡常数Kb的数量级为![]()
B.用![]() 的盐酸滴定10ml1mol/LNH2OH溶液至
的盐酸滴定10ml1mol/LNH2OH溶液至![]() ,消耗盐酸体积小于10mL
,消耗盐酸体积小于10mL
C.当溶液稀释至![]() 时,溶液中由水电离出的
时,溶液中由水电离出的![]()
D.![]() 溶液中离子浓度大小关系:
溶液中离子浓度大小关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38 mol4·L-4,Ksp[Cr(OH)3]=7.0×10-31 mol4·L-4,Ksp[Zn(OH)2]=1.0×10-17 mol3·L-3,Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3。当下列离子以氢氧化物的形式开始沉淀时,所需的pH最小的是( )
A.Fe3+B.Cr3+C.Zn2+D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
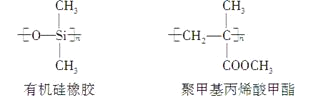
【题目】下列关于上述高分子生物材料的说法中正确的是( )
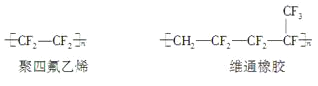
A.用于合成维通橡胶的单体是CH2=CF—CF2—CF2—CF3
B.用于合成有机硅橡胶的单体是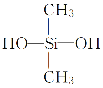
C.聚四氟乙烯、有机硅橡胶均可看作加聚反应的产物
D.有机硅橡胶、聚甲基丙烯酸甲酯均可通过缩聚反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,浓度均为
时,浓度均为![]() 的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是![]()
A.BOH溶于水,其电离方程式是![]()
B.在![]()
![]() 溶液中,
溶液中,![]()
C.若一定量的上述两溶液混合后![]() ,则
,则![]()
D.若将![]()
![]() 溶液稀释至
溶液稀释至![]()
![]() ,则溶液的
,则溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现给你一试管二氧化氮,其他药品和仪器自选。
(1)设计实验,要求尽可能多地使二氧化氮被水吸收。某化学兴趣小组实验设计如下,请你帮他们将下表补充完整。
实验步骤 | 现象 | 化学方程式(解释) | |
① | 将一支充满NO2的试管倒放在盛有水的水槽中 | ___ | ___ |
② | 制取少量氧气 | ___ | |
③ | ___ | ___ | 4NO2+2H2O+O2=4HNO3 |
(2)完成上述实验的装置图如图,请你在方框内将它补充完整(加持装置可省略),需标明所用药品的名称___。

(3)以上设计让你对工业上生产硝酸有什么启示___?(从原料的充分利用、减少污染物的排放等方面考虑)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是

A.甲烷的燃烧热△H=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)=CO(g)+2H2O(g) ΔH=-890.3kJ·mol-1
O2(g)=CO(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水所放出的热量少
C.根据右图金刚石在一定条件下转化成石墨提供的信息,可知生成物比反应物稳定,向外界放出的热量为E2 -E3
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 含有氢原子数为0.4NA的CH3OH分子中含有的共价键数目为0.5NA
B. a g某气体含分子数为b,c g该气体在标准状况下体积为![]() L
L
C. 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA
D. 常温下,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法中正确的是( )
①棉花、蚕丝和聚乙烯的主要成分都是纤维素
②甲烷、乙醇和乙酸在一定条件下都能发生取代反应
③等质量的乙烷、乙烯、苯充分燃烧,消耗氧气的量由多到少
④除去乙酸乙酯中残留的乙酸,加过量饱和Na2CO3溶液振荡后,静置分液
⑤乙酸乙酯和植物油均可水解生成乙醇
⑥乙烯、苯、乙醇、油脂都能使酸性KMnO4溶液褪色
A. ①⑤⑥ B. ②③④ C. ①②③ D. ②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com