
有以下9种物质:①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨AlCl3。
请用上述物质的序号填空:
(1)不存在化学键的是_____________________________________________________。
(2)只存在极性共价键的是______________________________________________________。
(3)只存在非极性共价键的是__________________________________________________。
(4)既存在非极性共价键又存在极性共价键的是______________________________________。
(5)只存在离子键的是_______________________________________________________。
(6)既存在离子键又存在共价键的是______________________________________________。
科目:高中化学 来源: 题型:
下列关于有机化合物的认识不正确的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的—CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法探究影响化学反应速率的因素。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案,研究影响反应速率的因素。
(1)甲同学的实验报告如表所示:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取三份等体积的2 mol·L-1硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应产生气泡的速率大小:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越大 |
该同学的实验目的是__________________,要想得出正确的实验结论,还需要控制的实验条件是________________________________________________________________________。
(2)乙同学为了能精确地研究浓度对反应速率的影响,在相同温度下利用如图所示装置进行定量实验。完成该实验应选用的实验药品是__________,应该测定的实验数据是____________。
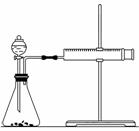
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内反应速率较小,溶液褪色不明显,但反应一段时间后,溶液突然褪色,反应速率明显增大。
(3)针对上述实验现象,某同学认为该反应放热,导致溶液的温度升高,从而使反应速率增大。从影响化学反应速率的因素看,你认为还可能是________的影响。
(4)若要用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还可以在反应开始时加入________(填字母)。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。
(1)写出硅烷分子式通式________________________________;
(2)写出乙硅烷在空气中自燃的化学方程式:_________________________________________________________________________________________________________________________________;
(3)相同状况下,甲硅烷的密度________(填“大于”“小于”或“等于”)甲烷;
(4)甲硅烷的热稳定性________(填“大于”“小于”或“等于”)甲烷。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)过氧化钠的电子式: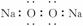 (×)
(×)
(2014·江苏,2A)
(2)氢氧根离子的电子式: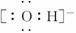 (√)
(√)
(2013·江苏,2B)
(3)NH4Br的电子式: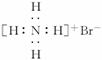 (×)
(×)
(2012·海南,9A)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
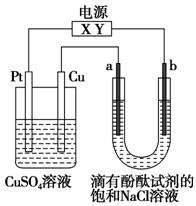
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )。
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-===Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
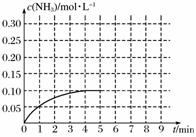
(1)该反应的化学平衡常数表达式为_______________________________。
(2)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为__________________。
(3)判断该反应达到平衡状态的标志是________(填序号)。
①N2和NH3浓度相等 ②NH3百分含量保持不变 ③容器中气体的压强不变 ④NH3的生成速率与H2的消耗速率相等 ⑤容器中混合气体的密度保持不变
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
①0.20 mol·L-1 ②0.12 mol·L-1 ③0.10 mol·L-1
④0.08 mol·L-1
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末至达到新平衡时NH3浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com