
| A. | 0.35mol/L | B. | 0.45mol/L | C. | 0.5mol/L | D. | 0.6mol/L |
分析 根据n=cV分别计算出硫酸钠、硫酸铝的物质的量,从而可知混合液中含有硫酸根离子的物质的量,最后根据c=$\frac{n}{V}$计算出溶液中硫酸根离子的物质的量浓度.
解答 解:50mL 0.3mol/L Na2SO4溶液中含有硫酸钠的物质的量为:0.3mol/L×0.05L=0.015mol,
50mL 0.2mol/L Al2(SO4)3溶液中含有硫酸铝的物质的量为:0.2mol/L×0.05L=0.01mol,
两溶液中含有硫酸根离子的物质的量为:0.015mol+0.01mol×3=0.045mol,
所以溶液中SO42-的物质的量浓度为:$\frac{0.045mol}{0.05L+0.05L}$=0.45mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 | |
| B. | 反应放出的热量为0.04 a kJ | |
| C. | 平衡时H2O的转化率为40% | |
| D. | 若将容器的体积压缩为1 L,有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0 kJ的热量 | |
| B. | 达到平衡时,SO2和SO3的浓度一定相等 | |
| C. | 反应体系中,当混合物的密度保持不变,反应达到平衡 | |
| D. | 增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
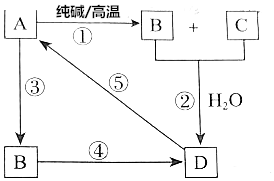 已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.
已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 升高温度 | C. | 减小压强 | D. | 加入O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| B. | 当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 | |
| C. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com