
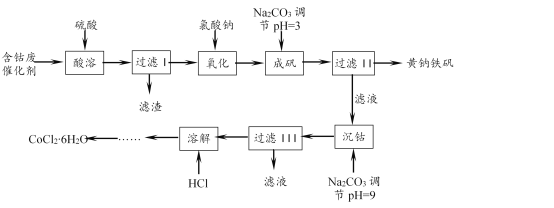
【题目】一种以含钴废催化剂(含Co、Fe、FeO、Fe2O3以及不溶于酸的杂质)制备氯化钴晶体与黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:
已知:KMnO4的氧化性强,可以氧化HBr、HCl、Fe2+等。
(1)“氧化”“成矾”需在加热条件下进行。“氧化”时反应的离子方程式为____。实验中能否选用KMnO4溶液检验Fe2+是否完全氧化,____(填“能”或“不能”),理由是____。
(2)该条件下,若用H2O2作氧化剂,实际H2O2的用量比理论用量要多,重要原因之一是H2O2发生了分解。该条件下H2O2分解较快的原因是:① ____;②____。
(3)成矾过程中反应的离子方程式为____。检验成矾是否完全的实验操作是____。
【答案】6Fe2+ + ClO3- + 6H+ ![]() 6Fe3+ + Cl- + 3H2O 否 反应后的溶液中有Cl-和H+,也会使KMnO4溶液褪色 温度升高,H2O2分解速率加快 Fe2+的催化作用使H2O2分解速率加快(或答Fe3+的催化作用) 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O
6Fe3+ + Cl- + 3H2O 否 反应后的溶液中有Cl-和H+,也会使KMnO4溶液褪色 温度升高,H2O2分解速率加快 Fe2+的催化作用使H2O2分解速率加快(或答Fe3+的催化作用) 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O ![]() Na2Fe6(SO4)4(OH)12 + 6CO2 取上层清液,向其中加入KSCN溶液,若溶液不变红,则已成矾完全
Na2Fe6(SO4)4(OH)12 + 6CO2 取上层清液,向其中加入KSCN溶液,若溶液不变红,则已成矾完全
【解析】
根据流程中发生的理化变化、结合物质的性质、应用化学反应原理解答问题。
(1)含钴废催化剂经“酸溶”、“过滤I”所得滤液中有FeSO4、Fe2(SO4)3等,而“过滤II”所得黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+3价。故“氧化”是将Fe2+变成Fe3+,反应的离子方程式为6Fe2+ + ClO3- + 6H+ ![]() 6Fe3+ + Cl- + 3H2O。“氧化”后溶液中有Cl-和H+,能使KMnO4溶液褪色,故不能用KMnO4溶液检验Fe2+是否完全氧化。
6Fe3+ + Cl- + 3H2O。“氧化”后溶液中有Cl-和H+,能使KMnO4溶液褪色,故不能用KMnO4溶液检验Fe2+是否完全氧化。
(2)用H2O2氧化Fe2+时,H2O2分解较快。从影响反应速率的因素分析原因:“氧化”在加热条件下进行,温度升高,H2O2分解速率加快; Fe2+或Fe3+的催化作用使H2O2分解速率加快。
(3)“成矾”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12],其中Fe3+ 、SO42- 来自氧化后的溶液、Na+ 来自NaClO3和Na2CO3、OH-只能来自CO32-水解。反应的离子方程式为 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O ![]() Na2Fe6(SO4)4(OH)12↓ + 6CO2↑。检验“成矾”是否完全,即检验成矾时Fe3+是否完全沉淀。实验操作是:取上层清液,向其中加入KSCN溶液,若溶液不变红,则成矾已完全。
Na2Fe6(SO4)4(OH)12↓ + 6CO2↑。检验“成矾”是否完全,即检验成矾时Fe3+是否完全沉淀。实验操作是:取上层清液,向其中加入KSCN溶液,若溶液不变红,则成矾已完全。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
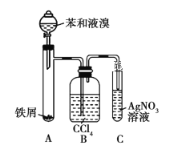
(1)装置A中发生反应的化学方程式是______________、______________。
(2)装置C中观察到的现象是______________,证明____________。
(3)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_________________,原因是___________________;如果没有装置B,将装置A、C直接相连,则该套实验装置_________(填“合理”或“不合理”),原因是___________。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_______(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧环己烯。其中既不能使酸性KMnO4溶液褪色,也不能使溴的CCl4溶液褪色的是( )
A.①②③⑤B.④⑥⑦⑧C.①④⑥⑦D.②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝的混合物进行如下实验:

(1)操作X的名称是___________。
(2)气体A是___________。
(3)加入足量NaOH 溶液时发生反应的离子方程式为______________;加入盐酸发生反应的离子方程式为_______________。
(4)溶液B 中阴离子除OH-外还有_________,溶液D中存在的金属离子为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世博园地区改造规划的实施将提升上海的环境质量。位于规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有( )
A. FeO粉尘 B. P2O5粉尘 C. Fe2O3粉尘 D. SiO2粉尘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
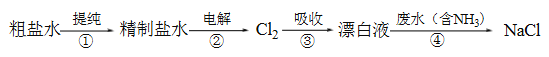
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是
A. CH4 + Cl2 ![]() CH3Cl + HCl B. CH2=CH2 + HBr → CH3CH2Br
CH3Cl + HCl B. CH2=CH2 + HBr → CH3CH2Br
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com