
下列有关非金属元素说法正确的是
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.SO2具有氧化性,可用于漂白纸浆
C.液氨汽化时要吸收大量的热,可用作制冷剂
D.硅是重要的半导体材料,常用于制作光导纤维
科目:高中化学 来源:2016-2017学年河北正定中学高一上第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加徳罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源:贵州省铜仁市2016-2017学年高一上期中化学试卷(解析版) 题型:选择题
下列电解质溶于水时的电离方程式中,书写正确的是
A.H2SO3 2H++SO32-
2H++SO32-
B.NaHSO4=Na++H++SO42-
C.NaHCO3=Na++H++CO32-
D.K2SO4=K2++SO42-
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月月考化学试卷(解析版) 题型:选择题
蛇纹石由MgO、Al2O3,、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3
C.在溶液Y中加入过量的NaOH溶液,过滤得到沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月月考化学试卷(解析版) 题型:选择题
下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是
A.氯化镁、氢氧化钠 B.硫酸钠、氢氧化钡
C.氯化铝、氨水 D.溴化亚铁、氯水
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上10月模块测试化学试卷(解析版) 题型:实验题
1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
可能大量含有的阴离子 | Cl﹣、Br﹣、I‑、ClO‑、AlO2﹣、CO32- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
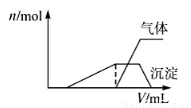
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有  ,
,
③要确定其存在可补充做的实验操作是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积 (标准状况) | 2.8L | 5.6L | 11.2L |
n(C | 1.25mol | 1.5mol | 2mol |
n(Br﹣) | 1.5mol | 1.4mol | 0.9mol |
n(I﹣) | a mol | 0 | 0 |
原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上10月模块测试化学试卷(解析版) 题型:选择题
用离子方程式解释以下指定反应,书写正确的是( )
A.亚硫酸钠溶液显碱性:SO32-+2H2O=H2SO3+2OH-
B.(NH4)2FeSO4溶液与过量NaOH溶液混合制取氢氧化亚铁:Fe2++2OH-=Fe(OH)2
C.NaAlO 2溶液中通入过量CO2制取氢氧化铝:2AlO2-+CO2+3H2O=2Al(OH)3+CO32-
2溶液中通入过量CO2制取氢氧化铝:2AlO2-+CO2+3H2O=2Al(OH)3+CO32-
D.铁红溶于HI酸溶液:Fe2O3+6H++2I-=2Fe2++I2+3H2O
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考二化学卷(解析版) 题型:选择题
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属恰好完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1 g 。下列叙述不正确的是( )
A.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol
B.参加反应的金属的总质量 3.6 g < m < 9.6 g
C.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=200 mL
D.当金属全部溶解时收集到NO气体的体积在标况下为 2.24 L
查看答案和解析>>
科目:高中化学 来源:2017届江西省赣州市十四校高三上期中联考化学试卷(解析版) 题型:填空题
铬是一种银白色的金属,化学性质稳定,用途广泛。 工业上以铬铁矿[主要成分是 Fe(CrO2)2]为原料冶炼铬及获得强氧化性 Na2Cr2O7,其工艺流程如下图所示:
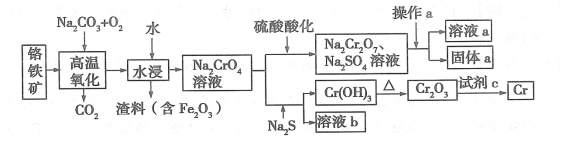
 (1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(2)写出利用铝热反应制取铬的化学方程式: ,试剂 c 通常还可以是 (至少写两种) 。
(3)酸化过程中,不选用盐酸的原因是 。
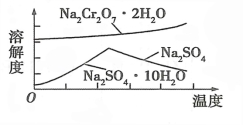
(4)固体 a 的主要成分是 Na2SO4·10H2O,根据图分析,操作a为 、 、过滤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com