
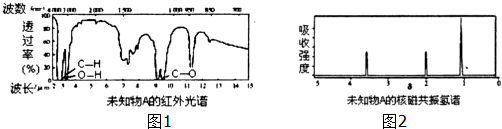
分析 (1)通过浓硫酸增重3.6g是水的质量,饱和氢氧化钠溶液增重6.6克是生成二氧化碳的质量,根据n=$\frac{m}{M}$计算水、二氧化碳的物质的量,再根据原子守恒计算C原子、氢原子的物质的量,根据m=nM计算C原子、氢原子的质量,进而计算有机物中O原子的质量,根据n=$\frac{m}{M}$计算氧原子的物质的量,确定最简式,结合相对分子质量计算该有机物的分子式.
(2)红外光谱显示A分子中只有“C-C”键、“C-H”键和“O-H”键的振动吸收,据此结合有机物的分子式,推断A可能的结构简式;
(3)A的核磁共振氢谱只有三个吸收峰,分子中含有3种H原子,据此结合A的分子式与红外光谱确定A的结构,书写方程式.
解答 解:(1)通过浓硫酸增重3.6g是水的质量,水的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,故n(H)=2×0.2mol=0.4mol,m(H)=0.4mol×1g/mol=0.4g,饱和氢氧化钠溶液增重6.6克是生成二氧化碳的质量,二氧化碳的物质的量为:$\frac{6.6g}{44g/mol}$=0.15mol,故n(C)=0.15mol,m(C)=0.15mol×12g/mol=1.8g,故有机物A中m(O)=3.8g-0.4g-1.8g=1.6g,故n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,所以n(C):n(H):n(O)=0.15mol:0.4mol:0.1mol=3:8:2,最简式为C3H8O2,该最简式中H原子已经达到饱和,则其最简式即为分子式,
故答案为:C3H8O2;
(2)根据图示可知,红外光谱显示A分子中只有“C-C”键、“C-H”键和“O-H”键的振动吸收,同一个碳原子上连接两个羟基不稳定
故符合结构特征的有机物A的结构简式为:CH3CH(0H)CH2OH CH2(OH)CH2CH2OH,
故答案为:CH3CH(0H)CH2OH、CH2(OH)CH2CH2OH;
(3)A的核磁共振氢谱只有三个吸收峰,分子中含有3种H原子,结合有机物A的红外光谱可知,A为CH2(OH)CH2CH2OH,A与足量金属钠反应的化学方程式为:CH2(OH)CH2CH2OH+2Na→NaOCH2CH2CH2ONa+H2↑;
A与氧气(加热,铜做催化剂)反应的化学方程式:CH2(OH)CH2CH2OH+O2$→_{△}^{Cu}$OHCCH2CHO+2H2O,
故答案为:CH2(OH)CH2CH2OH+2Na→NaOCH2CH2CH2ONa+H2↑;CH2(OH)CH2CH2OH+O2$→_{△}^{Cu}$OHCCH2CHO+2H2O.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,利用原子守恒确定有机物的分子式是解题的关键,注意掌握燃烧法沉淀有机物最简式的原理.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
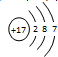 ,C的离子结构示意图
,C的离子结构示意图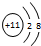 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>H2Se>HBr | B. | 还原性:Se2->S2->Cl- | ||
| C. | 原子半径:Se>Cl>P | D. | 酸性:H2SeO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com