
【题目】下列反应中,属于取代反应的是
A. 溴乙烷的水解反应 B. 实验室用乙醇制取乙烯
C. 葡萄糖与银氨溶液反应 D. 油脂的氢化
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是( ) ①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4molL﹣1 , SO42﹣的物质的量浓度为0.7molL﹣1 , 则此溶液中K+的物质的量浓度为( )
A.0.1 molL﹣1
B.0.15 molL﹣1
C.0.2 molL﹣1
D.0.25 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是________。
(3)步骤Ⅲ中发生反应的离子方程式为______________;反应温度一般需控制在35℃以下,其目的是___________________。
(4)已知Ksp[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中____(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是____。
(5)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32-+I2=2I+ S4O62-)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2) “氧的固定”中发生反应的化学方程式为_______________。
(3)取100.00 mL水样经固氧、酸化后,用a mol·L1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_________mg·L1。滴定结束后如果俯视滴定管读取数据,导致测定结果偏___________。(填“高”或“低”)
(4)Na2S2O3溶液不稳定,需使用前配制和标定。预估实验需要使用75mL的Na2S2O3溶液,则配制该溶液所必需的仪器有天平、烧杯、玻璃棒和___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是______________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。
该合金的晶胞结构如图所示。

①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
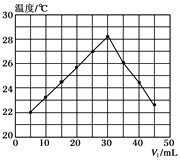
A. 做该实验时环境温度为22℃
B. NaOH溶液的浓度约为1.5mol/L
C. 该实验中需要使用环形玻璃搅拌棒在水平方向轻轻转动搅拌
D. 该实验可用相同物质的量的氢氧化钠固体投入盐酸中测定中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是
A.热稳定性:HF>H2O>NH3B.原子半径:Cl>S>P
C.碱性:NaOH>Mg(OH)2>Al(OH)3D.金属性:K>Na>Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组同学利用下图装置测定FeSO4·xH2O中结晶水含量,实验前测得装置A(包括石英玻璃管及两端开关K1和K2)的质量为m1g装入样品测得装置A的质量为m2g.下列有关说法错误的是
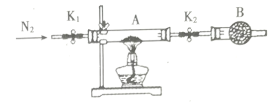
A. 仪器B的名称为球形干燥管,其中可装入碱石灰
B. 加热前先通入一段时间的N2以排除装置中的空气,目的是防止发生爆炸
C. 若加热直至恒重时,A的质量为m3g,则![]()
D. 若先加热一段时间后再通入N2或撤去B装置都会使x值偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com