
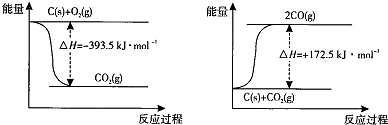
| 弱电解质 | H2CO3 | NH3.H2O |
| 电离平衡常数( 25℃) | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
| Kw |
| Kb |
| Kw |
| Ka2 |
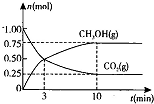
| △c |
| △t |
| 0.75mol/L |
| 10min |
| KW |
| 5.61×10 -11 |
| KW |
| 1.77×10 -5 |


科目:高中化学 来源: 题型:
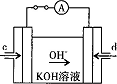
| A、电解时在阳极得到氯气,在阴极得到金属钠 |
| B、若在阳极附近的溶液中滴入淀粉KI溶液,溶液呈蓝色 |
| C、若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 |
| D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
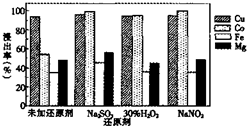
| A、是否使用还原剂对铜的浸出率影响很大 |
| B、用Na2SO3NaNO2作还原剂,钴的浸出率 均达98%,但工业上宜选用Na2SO3 |
| C、加入还原剂的主要目的是为了还原Fe3+ |
| D、用Na2SO3作还原剂可使镁元素以单质 形式析出而有较大浸出率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量CO2通入澄清石灰水中:CO2+Ca2++2OH-=CaCO3↓+H2O |
| B、Na2O2与水发生反应:O22-+H2O=2OH-+H2↑ |
| C、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D、Ca(HCO3)2与足量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
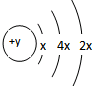 A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图为,D在同周期元素中原子半径最小,据此填空:
A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图为,D在同周期元素中原子半径最小,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验操作 | |
| A | 证明乙烯能发生加成反应 | 将乙烯气体通入溴的四氯化碳溶液中 |
| B | 鉴别Fe(OH)3胶体和FeCl3溶液 | 用激光笔分别照射两种物质,从侧面观察是否出现光亮的通路. |
| C | 检验酒精中是否含有水 | 取少量酒精加入无水硫酸铜粉末 |
| D | 鉴别苯、环已烯和已烷 | 加入酸性高锰酸钾溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com