
【题目】长期暴露在空气中,质量会增加的物质是( )
A.浓硫酸B.浓盐酸C.碳酸钠晶体D.氯化钠
科目:高中化学 来源: 题型:
【题目】如右图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时.c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是
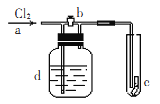
A. NaOH溶液 B. 饱和食盐水 C. Ca(OH)2溶液 D. 浓H2S04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成分SO2)来制取石膏(CaSO42H2O)和过二硫酸钠(Na2S2O8)。设计简要流程如图:
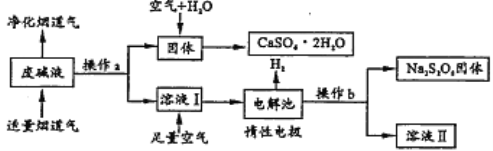
(1)烟道气中SO2与废碱生成沉淀的化学方程式为_____;操作a的名称是_____。
(2)生成CaSO42H2O过程中没有涉及到的化学反应类型为_____(填序号)。
A.复分解反应 B.化合反应 C.分解反应 D.氧化反应 E.置换反应
(3)溶液Ⅰ通入空气发生反应的化学方程式为_____。
(4)用惰性电极电解时,阳极生成Na2S2O8的电极反应为_____;在整个流程中可以循环利用的物质是H2O和_____(填化学式)。
(5)一定条件下将S8(s)、O2(g)、NaOH(s)转化过程中的能量关系用如图简单表示。则S8(s)燃烧的热化学反应方程式为_____。

(6)若制取ag Na2S2O8时,阳极有bL氧气(标况)产生。则电解生成的H2体积在标准状况下为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ag Mg、Al合金完全溶解在C1mol/L、V1LHCl溶液中,产生bmolH2。再向反应后的溶液中加入C2mol/LV2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。下列关系不正确的是
A. d=a+34b B. ![]()
C. 铝的质量为![]() D. 与金属反应后剩余盐酸为(C1V1-2b)mol
D. 与金属反应后剩余盐酸为(C1V1-2b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民生产中占有重要的地位.工业合成氨的反应为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4KJ/mol.请回答下列问题:
(1)表明合成氨反应处于平衡状态的是(填字母)
a.2v正(NH3)>3v逆(H2)b.c(N2)=c(H2)>c(NH3)
c.单位时间内有3molH﹣H键断裂,同时有6molN﹣H键断裂
d.恒温恒容时,容器内压强不变
e.恒温恒容时,容器内混合气体的弥补不变
(2)在一定条件下的密闭容器中,该反应达到平衡,既要加快反应速率,又要提高H2的转化率,可以采取的措施有(填字母)
a.升高温度 b.分离出液态氨气 c.增加N2浓度 d.增加H2浓度
(3)已知在400℃时,N2(g)+3H2(g)2NH3(g)的平衡常数K=0.5,则NH3(g)N2(g)+3H2(g)的平衡常数表达式为K= , 数值为 .
(4)有两个密闭容器A和B,A容器保持恒容,B容器爆出恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g)3H2(g)+N2(g).则:
①达到平衡所需的时间:t(A)t(B),平衡时,NH3的转化率:a(A)a(B)(填“>”、“=”或“<”).
②达到平衡后,在两容器中分别通入等量的氦气.A中平衡向移动,B中平衡向移动.(填“向正反应方向”、“向逆反应方向”、“不”).
(5)在三个相同容器中各充入1molN2和3molH2 , 在不同条件下反应并达到平衡,氨的体积分数[Ψ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是(填字母,下同). 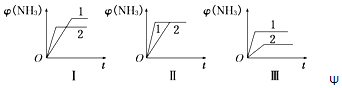
a.图Ⅰ可能是不同压强对反应的影响,且p2>p1
b.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A. 2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B. 常温下,2g氢气所含分子数目为NA
C. 在25℃,![]() 时,11.2L氮气所含的原子数目为NA
时,11.2L氮气所含的原子数目为NA
D. 标准状况下22.4L单质溴所含的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com