
【题目】在一定温度下的定容容器中,当下列各量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值⑦混合气体的总质量⑧混合气体的总体积⑨C、D的分子数之比为1∶1
A.①②③④⑤⑥⑦⑧ B.①③④⑤⑧⑨ C.①②③④⑤⑦ D.①③④⑤
【答案】D
【解析】
试题分析:①、由A(g)+2B(g) ![]() C(g)+D(g)可知,1+2=3>1+1=2,即正反应是气体物质的量减小的方向,同温同容下阿伏加德罗定律的推论
C(g)+D(g)可知,1+2=3>1+1=2,即正反应是气体物质的量减小的方向,同温同容下阿伏加德罗定律的推论![]() 可知,混合气体的压强逐渐减小(或是一个变量),当变量不再发生变化时,说明已达平衡,①正确;②、由
可知,混合气体的压强逐渐减小(或是一个变量),当变量不再发生变化时,说明已达平衡,①正确;②、由![]() 、质量守恒定律和题意可知,混合气体的质量不变,容器的容积也不变,因此混合气体的密度始终不变(或是一个不变量),不变量不再改变不能说明已达平衡,②错误;③、随着反应的进行,反应物(或生成物)的物质的量浓度逐渐减小(或增大)(或是一个变量),变量不再改变能说明已达平衡,③正确;④、由于正反应是气体物质的量减小的方向,随着反应的进行,混合气体的总物质的量逐渐减小(或是一个变量),变量不再改变能说明已达平衡,④正确;⑤、由
、质量守恒定律和题意可知,混合气体的质量不变,容器的容积也不变,因此混合气体的密度始终不变(或是一个不变量),不变量不再改变不能说明已达平衡,②错误;③、随着反应的进行,反应物(或生成物)的物质的量浓度逐渐减小(或增大)(或是一个变量),变量不再改变能说明已达平衡,③正确;④、由于正反应是气体物质的量减小的方向,随着反应的进行,混合气体的总物质的量逐渐减小(或是一个变量),变量不再改变能说明已达平衡,④正确;⑤、由![]() 、质量守恒定律、正反应是气体物质的量减小的方向可知,混合气体的平均相对分子质量逐渐减小(或是一个变量),变量不再改变能说明已达平衡,⑤正确;⑥、由于A(g)+2B(g)
、质量守恒定律、正反应是气体物质的量减小的方向可知,混合气体的平均相对分子质量逐渐减小(或是一个变量),变量不再改变能说明已达平衡,⑤正确;⑥、由于A(g)+2B(g) ![]() C(g)+D(g)中任意两种物质表示的平均反应速率之比等于系数之比,则v(C)∶v(D)始终等于1∶1(或是一个不变量),不变量不再改变不能说明已达平衡,⑥错误;⑦、由于A、B、C、D均是气体,由质量守恒定律可知,密闭容器中混合气体的总质量始终不变(或是一个不变量),不变量不再改变不能说明已达平衡,⑦错误;⑧、由题意可知,容器的容积保持一定,则混合气体的总体积保持恒定(或是一个不变量),不变量不再改变不能说明已达平衡,⑧错误;⑨、C、D的起始物质的量都是0,变化的物质的量相等(等于系数之比),则C、D的分子数之比始终为1∶1二者平衡时的物质的量相等(或是一个不变量),不变量不再改变不能说明已达平衡,⑨错误;答案选D。
C(g)+D(g)中任意两种物质表示的平均反应速率之比等于系数之比,则v(C)∶v(D)始终等于1∶1(或是一个不变量),不变量不再改变不能说明已达平衡,⑥错误;⑦、由于A、B、C、D均是气体,由质量守恒定律可知,密闭容器中混合气体的总质量始终不变(或是一个不变量),不变量不再改变不能说明已达平衡,⑦错误;⑧、由题意可知,容器的容积保持一定,则混合气体的总体积保持恒定(或是一个不变量),不变量不再改变不能说明已达平衡,⑧错误;⑨、C、D的起始物质的量都是0,变化的物质的量相等(等于系数之比),则C、D的分子数之比始终为1∶1二者平衡时的物质的量相等(或是一个不变量),不变量不再改变不能说明已达平衡,⑨错误;答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质比较中,正确的是
A. 热稳定性:Na2CO3 < NaHCO3
B. 常温时水溶性:Na2CO3 > NaHCO3
C. 与稀盐酸反应速率:Na2CO3 < NaHCO3
D. 相对分子质量:Na2CO3 < NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
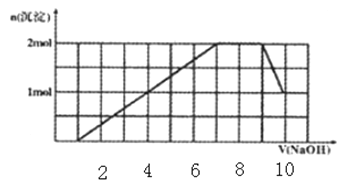
A. 原溶液中含有的Fe3+和Al3+的物质的量之比为1 : 1
B. 原溶液中一定含有SO42-和Na+
C. 反应最后形成的溶液中含有的溶质为Na2SO4
D. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,得到水的质量跟原芳香烃X的质量相等。则X的分子式为
A. C10H16 B. C11H14 C. C12H18 D. C13H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是( )
A. 溴蒸气被活性炭吸附 B. 电解水 C. HCl溶解于水 D. 打雷放电时,O2变成O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
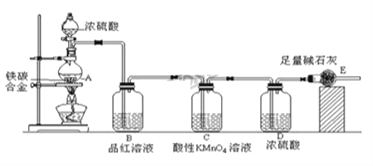
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
① 常温下碳与浓硫酸不反应;②________________________。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程____________________________。
(3)B中的现象是:_______________________;C的作用是:___________________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg.则铁碳合金中铁的质量分数为________________(写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融)![]() 4Na+O2↑+2H2O;后来盖吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
4Na+O2↑+2H2O;后来盖吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )

A. 电解熔融氢氧化钠制钠,阴极发生电极反应为:2OH--2e-═H2↑+O2↑
B. 盖吕萨克法制钠原理是利用铁的还原性比钠强
C. 若戴维法与盖吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D. 目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色;继续滴人BaC12溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2B.Cl-C.Fe3+D.NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)实验室用金属铜和稀硝酸制取NO的离子方程式: .
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图Ⅰ所示. 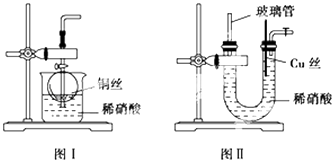
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这丝状材料的成分可以是(填选项编号).
A.铁 B.铝 C.银 D.玻璃 E.聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是(填化学方程式)
(3)为了证明铜丝与稀硝酸反应生成的确实是NO,某同学另设计了一套如图Ⅱ所示制取NO的装置.反应开始后,可以在U形管右端观察到无色的NO气体. ①长玻璃管的作用是 .
②让反应停止的操作方法及原因是 .
(4)以下收集NO气体的装置(见图Ⅲ),合理的是(填选项代号) 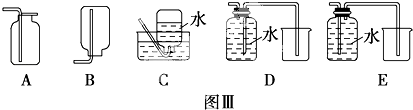
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com