
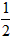 CaCO3+HNO3==
CaCO3+HNO3==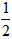 Ca(NO3)2+
Ca(NO3)2+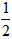 CO2��+
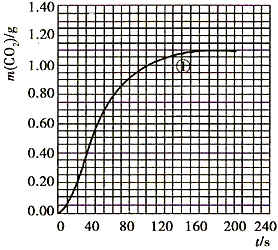
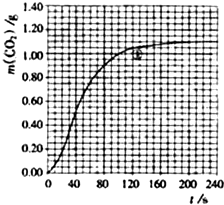
CO2��+ H2O������ʵ�����70~90s��Χ��HNO3��ƽ����Ӧ����(������Һ����仯��д���������)��
H2O������ʵ�����70~90s��Χ��HNO3��ƽ����Ӧ����(������Һ����仯��д���������)��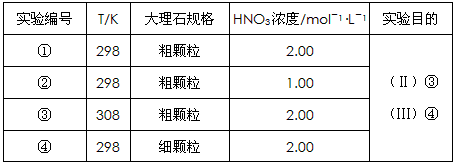


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�� ��� |
T/�� | ����ʯ ��� |
C��HNO3��/ mol?L-1 |
ʵ��Ŀ�� | �� | 25 | �ֿ��� | 2.00 | ���� ʵ��ٺ͢�̽��HNO3Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 ����ʵ��ں� �� �� ̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻����ʵ��ں� �� �� ̽������ʯ��֡�ϸ���Ը÷�Ӧ���ʵ�Ӱ�죻�� |
�� | 1.00 | �� | 35 | �� | ϸ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ���� | T/K | ����ʯ��� | HNO3Ũ�� | ʵ��Ŀ�� |
| �� | 298 | �ֿ��� | 2.00mol/L | ����ʵ��ٺ͢�̽��HNO3Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 ����ʵ��ٺ� �� �� ̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻����ʵ��ٺ� �� �� ̽������ʯ��� ���֡�ϸ���Ը÷�Ӧ���ʵ�Ӱ�죮 |
| �� | ||||
| �� | ||||
| �� |

| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ���� | �¶ȣ��棩 | ����ʯ��� | HNO3Ũ�ȣ�mol/L�� | ʵ��Ŀ�� |
| �� | 25 | �ֿ��� | 2.00 | ����ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻 ����ʵ��ٺ͢�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 ����ʵ��ٺ͢�̽�� ����ı���� ����ı���� �Է�Ӧ���ʵ�Ӱ�죻 |
| �� | 25 25 |
�ֿ��� �ֿ��� |
1.00 1.00 | |
| �� | 35 35 |
�ֿ��� �ֿ��� |
2.00 2.00 | |
| �� | 25 25 |
ϸ���� ϸ���� |
2.00 2.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
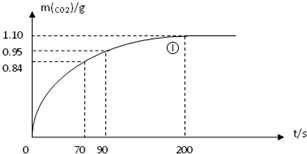
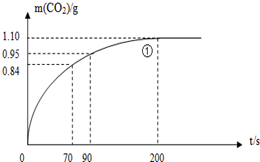 ij̽��С����HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����أ�����HNO3Ũ��Ϊ1.00mol/L��2.00mol/L������ʯ��ϸ�����ʹֿ������ֹ��ʵ���¶�Ϊ25�桢35�棬ÿ��ʵ��HNO3������Ϊ25.00mL������ʯ����Ϊ10.00g��
ij̽��С����HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����أ�����HNO3Ũ��Ϊ1.00mol/L��2.00mol/L������ʯ��ϸ�����ʹֿ������ֹ��ʵ���¶�Ϊ25�桢35�棬ÿ��ʵ��HNO3������Ϊ25.00mL������ʯ����Ϊ10.00g��| ʵ�� ��� |
�¶� ���棩 |
����ʯ ��� |
HNO3Ũ�ȣ�mol/L�� | ʵ��Ŀ�� |
| �� | 25 | �ֿ��� | 2.00 | ��I��ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻 ��II��ʵ��ٺ͢�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 ��III��ʵ��ٺ͢�̽�� �������ʵı���� �������ʵı���� �Է�Ӧ���ʵ�Ӱ�� |
| �� | 25 | �ֿ��� | 1.00 1.00 | |
| �� | 35 35 |
�ֿ��� | 2.00 | |
| �� | 25 | ϸ���� | 2.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
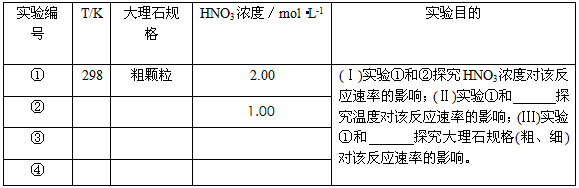
| ʵ���� | T/K | ����ʯ��� | HNO3Ũ��/mol?L-1 | ʵ��Ŀ�� |
| �� | 298 | �ֿ��� | 2.00 | ����ʵ��ٺ͢�̽��HNO3Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 ����ʵ��ٺ� ����ʵ��ٺ� |
| �� | ||||
| �� | ||||
| �� |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com