
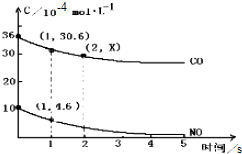
分析 利用v=$\frac{△c}{△t}$计算v(CO),根据速率之比等于化学计量数之比求v(N2),根据随着反应进行反应速率越来越小分析第2s时的x值范围.
解答 解:一氧化碳的反应速率为v(CO)=$\frac{△c}{△t}$=$\frac{(36-30.6)×1{0}^{\\;-4}mol/L}{1s}$=5.4×10-4mol/(L.s),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以v(N2)=$\frac{1}{2}$v(CO)=2.7×10-4mol/(L.s);
因为随着反应进行反应速率越来越小,所以第2S消耗的CO小于第1S的36-30.6=5.4,则第2s时的30.6>x>30.6-5.4=25.2,
故答案为:2.7×10-4mol/(L.s);30.6>x>25.2.
点评 本题考查化学反应速率的计算和化学反应速率的影响因素,为高频考点,侧重于分析、理解能力及计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 同温下分别在100g水中最多能溶解的无水CuSO4和CuSO5•5H2O的质量 | |
| B. | 纯水在25℃和90℃时的pH值 | |
| C. | 25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 | |
| D. | 在反应NH3+NO→N2+H2O中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的单质能够用来制造光导纤维 | |
| B. | Z、W、M的氧化物均可做耐高温材料 | |
| C. | 工业上常用电解熔融氯化物的方法制备Z、W的单质 | |
| D. | Y的单质都有剧毒,而且其着火点低,常保存在冷水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
| A. | 金属晶体的熔点不一定比分子晶体的高 | |
| B. | 表中共价化合物分子的所有原子都形成了8电子结构 | |
| C. | 同族元素的氧化物形成的晶体类型一定相同 | |
| D. | AlF3、AlCl3、BCl3都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 | |
| B. | 氯气是塑料、合成橡胶、合成纤维、农药、染料及药品的重要原料 | |
| C. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| D. | 用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3价 | B. | +6价 | C. | +4价 | D. | +5价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com