
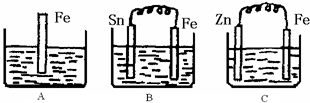
 A��B��C�����ձ��зֱ�ʢ��200mL��ͬ���ʵ���Ũ�ȵ�ϡ���
A��B��C�����ձ��зֱ�ʢ��200mL��ͬ���ʵ���Ũ�ȵ�ϡ���| n |
| V |
| 0.15mol |
| 0.2L |


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ϻ���������2011�����һģ��ѧ���� ���ͣ�021
|
Ũ����ͬ��NaOH��Һ��100 ml����A��B��C�����ձ��У��ֱ���������Һ��ͨ�벻������CO2����ַ�Ӧ����������������Һ����μ���0.2 mol/L�����ᣬ����CO2������������������֮���ϵ����ͼ��ʾ�������ж���ȷ����
| |
A�� |
ԭNaOH��Һ��Ũ��Ϊ0.2 mol/L |
B�� |
B�ձ���ͨ���CO2���Ϊ448 mL |
C�� |
ͨ��CO2����ȷ��A�ձ��е����� |
D�� |
ͨ��CO2��C�ձ������ʳɷֵ����ʵ���֮��Ϊ n(NaOH)��n(Na2CO3)��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ϻ���������2010������ڶ���ģ�⿼�Ի�ѧ�Ծ� ���ͣ�ѡ����
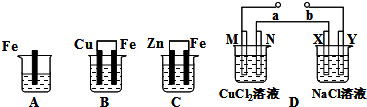
�����£���a��b��c����ʢ����ͬ�������ͬŨ�ȵ�ϡH2SO4���ձ��У��ֱ����������ı������ͬ��п��Ȼ����a��ͬʱ��������CuSO4��Һ��c�м�����������ˮCH3COONa���塣���и�ͼ�б�ʾ����������������V����ʱ�䣨t���Ĺ�ϵ�����п�����ȷ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ��ӱ�ʡ�����и�һ���£���ĩ��ѧ�Ծ��������棩 ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com