
| A. | 任何化学反应都伴随能量变化 | |
| B. | 化学反应中的能量变化都表现为热量的变化 | |
| C. | CH4的完全燃烧过程中放出热量,属于放热反应,即反应物的总能量低于生成物的总能量 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应过程中吸收热量,属于吸热反应,即反应物的总能量高于生成物的总能量 |
分析 A.依据化学反应的实质是断裂化学键和生成新的化学键的过程,任何化学反应都伴随物质变化和能量变化;
B.化学反应中的能量变化形式有多种,如光能、声能、电能等;
C.化学反应能量守恒分析判断反应能量变化;
D.化学反应能量守恒,反应物能量低于生成物能量,反应为吸热反应;
解答 解:A.任何化学反应能量守恒,化学反应的特点是有新物质生成,新物质和反应物的总能量是不同的,所以任何化学反应都伴随有能量变化,故A正确;
B.化学反应中的能量变化形式有多种,如光能、声能、电能等,但通常表现为热量的变化,其它各种形式的能量有时和热能的变化相伴发生,故B错误;
C.反应物总能量低于生成物总能量为吸热反应,CH4的完全燃烧过程中放出热量,属于放热反应,即反应物的总能量高于生成物的总能量,故C错误;
D.Ba(OH)2•8H2O与NH4Cl反应过程中吸收热量,属于吸热反应,即反应物的总能量低于生成物的总能量,故D错误;
故选A.
点评 本题考查化学反应中的能量变化,解析该题的关键在于理解化学反应吸热、放热的本质.平时学习概念时需理解记忆,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.2NA个NH3分子的质量为3.4g | |
| B. | 2.7g金属铝所含电子数目为0.3NA | |
| C. | 7.1 g Cl2变为氯离子时,得到的电子数一定为0.1NA | |
| D. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,不跟任何酸起反应 | |
| B. | 二氧化硅的化学键是共价键,可溶于水制得硅酸 | |
| C. | 根据CO2通入水玻璃中可制得硅酸,可知碳酸的酸性比硅酸强 | |
| D. | 硅在常温下能跟氢气起反应生成SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:X2Y>X2R | |
| B. | WY2能与碱反应,但不能与任何酸反应 | |
| C. | Z与Y形成的化合物不能作为耐高温材料 | |
| D. | 原子半径按X、Y、Z、R、W的顺序依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符 号 | 元素原子结构 |
X | 原子结构示意图为 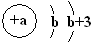 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
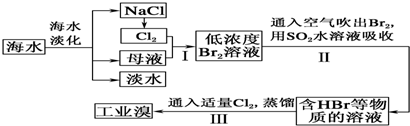
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 红磷和白磷 | B. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H | ||
| C. | H2O和D2O | D. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com