
下列离子方程式正确的是
A.足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O 2HCO3-
2HCO3-
B.FeSO4溶液在空气中变质:4Fe2++O2+2H2O 4Fe3++4OH-
4Fe3++4OH-
C.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O 2Al(OH)3↓+CO32-
2Al(OH)3↓+CO32-
D.碳酸氢镁溶液中加入过量石灰水:
Mg2++2HCO3-+2Ca2++4OH- 2CaCO3↓+ Mg(OH)2↓+ 2H2O
2CaCO3↓+ Mg(OH)2↓+ 2H2O
科目:高中化学 来源: 题型:
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取8.16mL稀盐酸
B.用托盘天平称取25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL碱式滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL
查看答案和解析>>
科目:高中化学 来源: 题型:
单质A、B、C和化合物D、E、F,在一定条件下有如下图的转化关系:(有部分反应物或者生成物未标出)
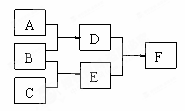
请回答下列问题:
(1)若A是空气中含量最多的气体,B在C中燃烧火焰呈苍白色。A与B反应生成D的化学方程式是__________________。D与E反应的现象是___________。D在催化剂作用下被氧气氧化是工业制备硝酸的主要反应之一,该反应的化学方程式是_____________。
(2)若A是金属单质,D是淡黄色固体,E在空气中含量增加会导致温室效应。则D的用途之一是__________,D与E反应生成F的化学方程式是__________________________。可以通过______________实验来检验D和F中所含的金属元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
C.12 g石墨和C60的混合物中质子总数一定为6NA个
D.常温常压下,22.4L乙烯中C−H键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、O、Si、Cl等。
23.氯元素原子最外电子层上有 种能量不同的电子,该元素的简单阴离子核外电子排布式是 。
24.由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于 晶体,请写出该化合物的化学式 。
25.下列事实能说明氯与氧两元素非金属性相对强弱的有 。(选填编号)
a.Cl原子最外层电子数比氧多 b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为−2价 d.沸点:H2O>HCl
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。
工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:
NaClO2 +HCl ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)
26.上述方程式中,缺项物质是___________,配平方程式,并在下面补全反应物系数。
____NaClO2 +____HCl
27.该反应中氧化剂和还原剂的物质的量之比是 。生成0.2 mol ClO2转移电子的物质的量为 _______ mol。
28.ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种无毒气体。处理100m3这种污水,至少需要ClO2 _______
mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是____ ________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明_ _______
② 称取Mg(NO3)2固体3 . 79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③ 观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④ 待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g
⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: _________________ ____(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z四种元素原子序数依次减小。已知W的原子序数为29;X原子p轨道共有11个电子;Y是第三周期主族元素,其部分电离能数据如下表;Z原子价电子排布式为nsnnpn。请回答下列问题:
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1 823 | 2 751 | 11 584 | 14 837 |
(1)W基态原子的电子排布式为______________。
(2)电负性:X________Y(填“>”、“=”或“<”)。
(3)R是与X同主族的短周期元素。R的氢化物沸点比X的氢化物高,原因是______。
(4)Z2X4中,Z原子采用________杂化,每个分子中含有________个σ键,________个π键。
(5)已知W2+能与氨分子形成配离子[W(NH3)4]2+,该配离子中存在的化学键有________。(填标号)
A.金属键 B.离子键 C.共价键 D.配位键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com