
【题目】已知在酸性溶液中,下列物质氧化H2S生成S是时,自身发生如下变化: IO3-→I2; Fe3+→Fe2 +; SO2→S;MnO4-→Mn2+ 。如果分别用等物质的量的这些物质氧化足量的H2S,得到S最多的是( )
A.IO3- B.Fe3+ C.SO2 D. MnO4-
科目:高中化学 来源: 题型:
【题目】紫外线吸收剂BAD是天津合成材料研究所与天津市有机化工一厂合作研制的项目。利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知C不能发生银镜反应。BAD的合成路线如下:BAD的结构简式为:
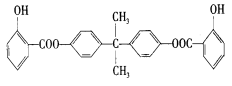

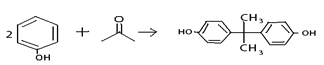
已知双酚H可以采用苯酚与丙酮在酸性条件下催化缩合而成:
试回答下列问题:
(1)写出结构简式:Y ;D 。
(2)属于取代反应的有 (填数字序号)。
(3)1 mol BAD最多可与含 mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④:_________________________________;
E+H→BAD 。(不须写反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_____________
(2)实验过程中,装置B、C中发生的现象分别是_______________、______________,这些现象分别说明SO2具有的性质是______和 。装置B中发生反应的离子方程式为_________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。
(5)碳单质和浓硫酸会在加热时发生反应,写出反应化学方程式
除去CO2中含有的少量SO2可选择通过 溶液 。
(6)描述实验室稀释浓硫酸的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池说法正确的是( )

A.重油是石油分馏的产品,含有的主要元素为C、H、O
B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
C.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
D.电池工作时,CO32-向电极B移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等。可用于制食盐、Mg、Br2、H2、Cl2、NaOH等化工原料。回答下列问题:
(1)Mg元素位于周期表第______周期_______族。
(2)写出NaOH的电子式_______________。
(3)写出电解饱和食盐水的离子方程式:____________。
(4)海水提溴要经过富集、氧化、提取的过程。其中氧化后生成的Br2可用Na2CO3溶液吸收,生成NaBr和NaBrO3及一种气体,写出该反应的化学方程式__________________。
(5)海水提取镁的过程中,得到MgCl2溶液后,先蒸发浓缩、冷却结晶、过滤制得MgCl2·6H2O,然后在HCl气流中加热得到MgCl2,而不是直接蒸发MgCl2溶液的原因是______________。
(6)海洋底部存在的可燃冰,是可开发的中药能源。常温常压下燃烧3.2g甲烷生成液态水,放出178kJ/mol的热量。写出甲烷燃烧的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子酯为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为 。
(5)G中的官能团有 。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.合成氨反应中为了提高正反应速率,及时抽走氨气
B.SO2催化氧化中通入过量空气可提高SO2的平衡转化率
C.合成氨中加入催化剂可提高氮气的平衡转化率
D.合成氨反应中缩小容器体积可以使平衡正向移动,所以氮气浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙酸是弱酸的实验事实是
A.CH3COOH溶液与Zn反应放出H2
B.0.1 mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
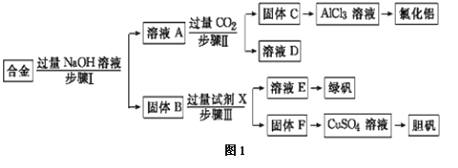
【题目】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图1实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。
请回答:
(1)写出步骤Ⅱ反应的离子方程式: 。
(2)步骤Ⅰ、Ⅱ、Ⅲ进行的实验操作中均需用到的玻璃仪器有 。
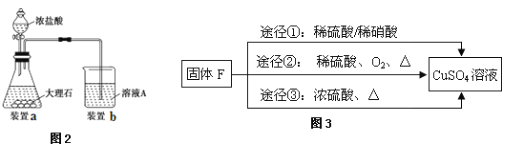
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是 。
(4)从溶液E得到绿矾晶体的实验操作是 。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:
写出途径③中反应的化学方程式: ,用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为 。
(6)用惰性电极电解硫酸铜溶液一段时间后,阴极增重3.2g。请写出阳极电极反应式 ,阳极产生 L气体(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com