
长式周期表共有18个纵行,从左到右排为1﹣18列,即碱金属为第一列,稀有气体元素为第18列.按这种规定,下列说法正确的是()
A. 第9列中元素中没有非金属元素
B. 只有第二列的元素原子最外层电子排布为ns2
C. 第四周期第9列元素是铁元素
D. 第10、11列为ds区
考点: 元素周期表的结构及其应用.
专题: 元素周期律与元素周期表专题.
分析: A.第9列属于Ⅷ族,都是金属元素;
B.氦原子及一些过渡元素原子最外层电子排布也为ns2;
C.第四周期第9列元素是钴元素;
D.第11、12列为ⅠB、ⅡB族,属于ds区.
解答: 解:A.第9列属于Ⅷ族,都是金属元素,没有非金属性元素,故A正确;
B.氦原子及一些过渡元素原子最外层电子排布也为ns2,故B错误;
C.第四周期第9列元素是钴元素,铁元素处于第四周期第8列,故C错误;
D.第11、12列为ⅠB、ⅡB族,属于ds区,第10列属于Ⅷ族,故D错误;
故选:A.
点评: 本题考查元素周期表的结构,难度不大,注意整体把握元素周期表.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
常见的永久磁铁的组成为BaFe12O19与曾用于雷达微波过滤器里的钇铁榴石(Y3Fe5O12)均为铁氧体。钇(Y)是稀土元素,常为+3价。它们的组成中所含铁元素的价态应为 ( )。
A.只有+2价 B.只有+3价
C.+2和+3价 D.+2和+6价
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢 化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓 溶液。下列说法正确的是
A. 元素Y的最高正化合价为+6
B. 离子半径的大小顺序为W>Q>Z>X>Y
C. 氢化物的沸点Y>Q
D. 元素W的最高价氧化物对应的水化物酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是()
①H2O ②NH3 ③F﹣ ④CN﹣ ⑤CO.
A. ①② B. ①②③ C. ①②④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O.下列说法正确的是()
A. 汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一
B. N2中π键与σ键之比为1:2
C. 反应③中每生成标况下的22.4 L N2转移电子数1.5NA
D. NH3的沸点比PH3的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
在醇RCH2CH2OH中化学键如图,则下列说法中正确的是( )
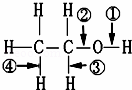
|
| A. | 当该醇发生催化氧化时,被破坏的键是②③ |
|
| B. | 当该醇与Na反应时,被破坏的键是① |
|
| C. | 当该醇与羧酸发生酯化反应时,被破坏的键是② |
|
| D. | 当该醇发生消去反应时,被破坏的键是②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。

(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com