
| A. | ②⑤⑥ | B. | ①④⑤ | C. | ①④⑦ | D. | ①④⑤⑦ |
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 在合成氨的反应中,增大压强有利于氨的合成 | |
| B. | H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深 | |
| C. | 新制的氯水在光照下颜色变浅 | |
| D. | 氯气可以用排饱和食盐水的方法收集(Cl2+H2O═HCl+HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
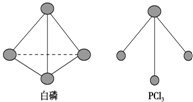 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入碘水,观察颜色反应 | B. | 分别加热,观察是否生成沉淀 | ||
| C. | 加入淀粉酶观察是否水解 | D. | 分别加入KI溶液,观察颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用下列装置制取并收集纯净的氯气,试回答下列问题:
用下列装置制取并收集纯净的氯气,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q2>Q1=92.4kJ | B. | 2Q2=Q1=92.4kJ | C. | 2Q2<Q1<92.4kJ | D. | 2Q2=Q1<92.4kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com