
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Be与水反应会更快 |
| B | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| C | SiH4,PH3在空气中能自燃 | H2S在空气中也能自燃 |
| D | 标况下HCl,HBr均为气体 | HF也为气体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.金属性越强,与水反应越剧烈;
B.非金属性越强,氢化物越稳定;
C.自燃与物质稳定性有关,硫化氢较稳定;
D.HF可形成氢键.
解答 解:A.金属性越强,与水反应越剧烈,则Be与水反应很缓慢,故A错误;
B.非金属性越强,氢化物越稳定,由事实可知,HBr的分解温度介于二者之间,故B正确;
C.自燃与物质稳定性有关,硫化氢较稳定,则H2S在空气中不能自燃,故C错误;
D.HF可形成氢键,标况下HCl、HBr均为气体,但HF也为液体,故D错误;
故选B.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的性质、元素周期律、氢键等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与CO2反应 | B. | H-Cl→H+Cl | ||
| C. | H2SO4+2NaOH=Na2SO4+2H2O | D. | C(s)+H2O(g)=CO(g)+H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
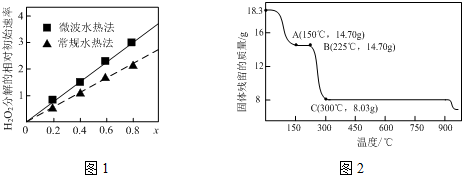
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水中滴入酚酞溶液,溶液变红:NH3•H2O=NH4++OH- | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 | |
| D. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O=2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧原子的原子结构示意图: | |
| B. | 羟基的结构式:O-H | |
| C. | 用电子式表示Na2O的形成过程: | |
| D. | 组成为C2H6O的分子中可能只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |  |
| A | 稀盐酸 | 浓碳酸钠溶液 | 立即产生气泡 | |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
| C | 氯化亚铁溶液 | 过氧化钠固体 | 产生气体和红褐色沉淀 | |
| D | 氢氧化钠溶液 | 氧化铝粉末 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | y=x%<$\frac{1}{2}$ | B. | y=1-x%>$\frac{2}{3}$ | C. | y=x%>$\frac{1}{3}$ | D. | y=1-2x%>$\frac{1}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

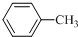 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
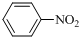 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧气氧化)
(苯胺,易被氧气氧化) .
. .写出③的转化关系
.写出③的转化关系 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (用已知中的表达方式表示,不用写化学方程式).
(用已知中的表达方式表示,不用写化学方程式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
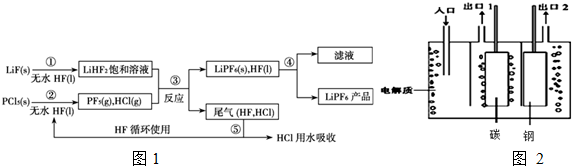
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com