
| A. | 0.1 mol NH4+含有的电子数为1.1NA | |
| B. | NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂 | |
| C. | 0.1 L 3 mol•L-1的NH4NO3溶液中氮原子数等于0.6NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA |
分析 A、铵根离子为10电子微粒;
B、NH4+中N元素的化合价为-3,处于氮元素的最低价态,只有还原性;
C、求出硝酸铵的物质的量,然后根据1mol硝酸铵中含2molN原子来分析;
D、反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O转移15mol电子,生成4mol氮气;
解答 解:A、铵根离子为10电子微粒,故0.1mol铵根离子中含NA个电子,故A错误;
B、NH4+中N元素的化合价为-3,处于氮元素的最低价态,只有还原性,故在氧化还原反应中常做还原剂,故B错误;
C、溶液中硝酸铵的物质的量n=CV=3mol/L×0.1L=0.3mol,而1mol硝酸铵中含2molN原子,故0.3mol硝酸铵中含0.6NA个氮原子,故C正确;
D、反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O转移15mol电子,生成4mol氮气,故但生成56g氮气即2mol氮气时,转移7.5NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
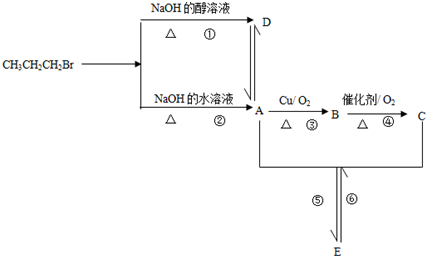
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 滴入数滴硫酸铜溶液 | ||
| C. | 加入少量NaCl溶液 | D. | 加入少量KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | T的氧化物属于两性氧化物 | |
| D. | W的氧化物对应的水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的总能量一定高于C和D的总能量 | |
| B. | A的能量一定低于C的,B的能量一定低于D的 | |
| C. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| D. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 6种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com