
【题目】燃料电池利用原电池的工作原理将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能:能有效提高能源利用率,具有广泛的应用前景。某种燃料电池的总反应式是:CH4+2O2+2OH-=CO32-+ 3H2O,装置如下图所示,该电池用金属铂片作电极在两极上分别通甲烷和氧气。请思考回答以下问题:
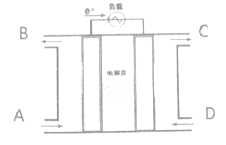
(1)电解质溶液可能是_________________;阳离子的移动方向:___________。(“左→右”、“右→左”)
(2)D气体通入的电池的_________极,发生的电极反应式:__________________;A通入的是______________,发生的电极反应式:_________________。
(3)当该电子流经导线的电子为4mol时,A入口至少需要通入_______L的气体(标准状态下)。
【答案】 NaOH或KOH 左![]() 右( 正极 O2+4e-+2H2O=4OH- CH4 CH4+8e-+10H-=CO32-+7H2O 11. 2L
右( 正极 O2+4e-+2H2O=4OH- CH4 CH4+8e-+10H-=CO32-+7H2O 11. 2L
【解析】(1)燃料电池的总反应式是:CH4+2O2+2OH-=CO32-+ 3H2O,可知电解质溶液是碱性溶液,可能是NaOH或KOH;由装置图可知,电子流出的极为负极,即左边电极为负极,则原电子工作时阳离子的移动方向左→右;
(2)右侧电极为正极,通话气体为氧气,则D气体通入的电池的正极,发生的电极反应式为O2+4e-+2H2O=4OH-;A通入的是CH4,发生的电极反应式CH4+8e-+10H-=CO32-+7H2O;
(3)当该电子流经导线的电子为4mol时,A入口甲烷的物质的量为4mol×![]() =0.5mol,标准状况下体积为0.5mol×22.4L/mol=11.2L。
=0.5mol,标准状况下体积为0.5mol×22.4L/mol=11.2L。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是
A.纯碱— NaOHB.漂白粉— NaClO
C.大理石— CaCO3D.烧碱— Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
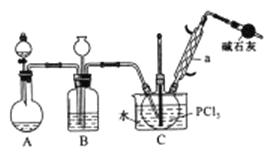
【题目】三氯氧磷(POCl2)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)装置A中发生反应的化学方程式为___________________________。
(2)B装置的作用除观察O2的流速之外。还有__________________________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取xg 产品于锥形瓶中,加入足量NaOH 溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol/L 的AgNO3容液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol/LNH4SCN 溶液滴定过量Ag+至终点,记下所用 体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是________________(填标号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量百分含量为(列出算式)____________________。
③步骤Ⅲ加入硝基苯的目的是_________________,如无此操作,所测Cl元素含量将会____________填“偏大”“ 偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在周期表中的相对位置如图所示,其中Z的最外层电子数等于其最内层电子数。下列说法正确的是

A. 简单离子的半径:Z>Y>X
B. WX 与ZX中的化学键类型相同
C. 元素的非金属性:Y>X>W
D. Y的氢化物的水溶液可使红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:
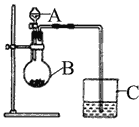
(1)仪器A的名称是________,应盛放下列药品中的__________。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________,应盛放下列药品中的__________。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________,即可说明___________比________酸性强,非金属性________比______强,B中发生反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02mol CO2和0.01 mol CO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_____g。
(2)已知:2CO(g)+O2(g)==2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。则反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ/mol。
CO2(g)+O(g)的△H=_________kJ/mol。
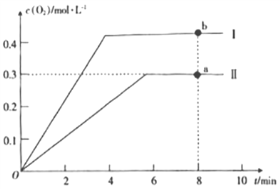
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。

①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母)。
A.CO的体积分数保持不变 B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析上图,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=___(计算结果保留1位小数)。
③向2L的恒容密闭容器中充入2molCO2(g),发生反应: 2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种固态烃的分子式为C12H12,经测定分子中无环状结构,由此推测该烃分子中最多含有碳碳双键的数目为( )
A. 6 B. 7 C. 10 D. 14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将cmol/L氨水滴入10mL.0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
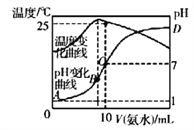
A. c=0.1
B. 25℃时,NH4Cl的水解常数(KA)=(10c-1)×10-7
C. 水的电离程度:B>C>A>D
D. B点:c(NH3·H2O)+c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com