
[2012·北京朝阳区一模](10分)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
Ⅰ. 打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ. A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是__ ____。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
科目:高中化学 来源:2013届新课标高三配套月考(一)化学试卷(B卷)(带解析) 题型:实验题
[2012·北京朝阳一模](12分)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: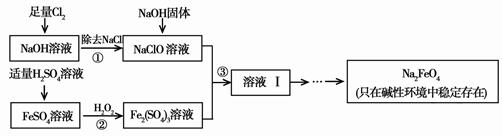
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是____ ____。
(2)步骤②反应的离子方程式是_____ ___。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为___ _____。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH_____(填“高”或“低”)。
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是____ _
(答出两点即可)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(一)化学试卷(B卷)(解析版) 题型:实验题
[2012·北京朝阳一模](12分)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:

回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是____ ____。
(2)步骤②反应的离子方程式是_____ ___。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为___ _____。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH_____(填“高”或“低”)。
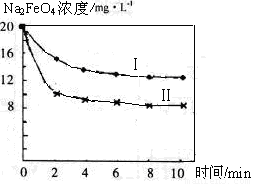
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是____ _
(答出两点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com