
| A、明矾既可以除去水中的悬浮物,也可以杀菌消毒 | B、可以通过电解明矾溶液来制取Al | C、用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高 | D、可以用在某溶液中加入盐酸酸化的氯化钡溶液的方法来确定该溶液中是否含有SO42- |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
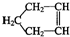 可简写为
可简写为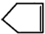 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: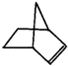
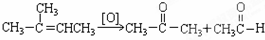
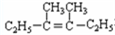 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物可能含有共价键 | B、常温下的气体分子中一定都含有共价键 | C、共价化合物中可能含有离子键 | D、非极性分子中一定都含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CsOH在水溶液中的电离方程式为CsOH═Ca++OH- | B、CsOH溶液能使酚酞试液变红 | C、因为CsCl是易溶于水的盐,所以CsOH溶液与稀盐酸不发生复分解反应 | D、CsOH溶液与MgCl2溶液发生复分解反应,有氢氧化镁沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠能与二氧化碳反应,可用作呼吸面具的供氧剂 | B、氧化铝的熔点高,可用于制作耐高温仪器 | C、二氧化硅有导电性,可用于制作光导纤维 | D、石灰石是制水泥和玻璃的主要原料之一 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+,下列说法不正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+强
B.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
C.在H2O2分解过程中,溶液的pH逐渐下降
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:填空题
(16分)废旧锂离子电池的正极材料(主要含有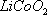 及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
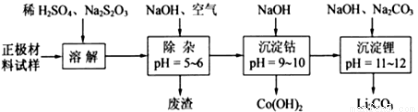
已知:Fe3+开始沉淀pH=2.7, 完全沉淀pH=3.2; Al3+开始沉淀pH=3.8, 完全沉淀pH=5.2; Co2+完全沉淀pH=9.15
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为 ,氧化剂是_________________________________。
(2)在上述除杂过程中,通入空气的作用是_____________________。通入空气和加入NaOH溶液后发生的离子方程式是______________ 废渣的主要成分是Al (OH)3和_______________。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为_________________、_________________。
(4)该工艺可回收的副产品是_________________________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com