
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述中,错误的是( )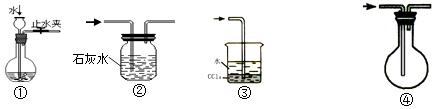
A.装置①可用于检查装置的气密性
B.装置②可用于除去CO中混有的少量CO2
C.装置③可用于安全吸收极易溶于水的氯化氢来制盐酸
D.装置④可用于排空气收集CO
【答案】D
【解析】A.关闭止水夹,注入水,当烧瓶中液面与长颈漏斗导管中液面的高度在一段时间不变,则气密性良好,A不符合题意;
B.二氧化碳与石灰水反应,而CO不能,气体长进短出可除杂,B不符合题意;
C.HCl极易溶于水,四氯化碳的密度比水的密度大,与水分层,可隔绝气体与水,装置可防止倒吸,C不符合题意;
D.CO的密度与空气的密度接近,不能利用排空气法收集,应选排水法,D符合题意;
故答案为:D.
A.检验装置气密性根据装置特点可用微热法与;液差法。B.CO2为酸性氧化物而CO为不成盐氧化物可用碱液洗气除CO2;C.HCl极易溶于水,四氯化碳的密度比水的密度大,与水分层,可隔绝气体与水,装置可防止倒吸;D.CO的密度与空气的密度接近,不能利用排空气法收集.


科目:高中化学 来源: 题型:
【题目】
(1)根据反应8NH3+3Cl2=6NH4Cl+N2 , 回答下列问题:
①该反应中氧化剂是 , 氧化产物是。
②该反应中被氧化的物质与被还原的物质物质的量之比为。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是 , 还原剂是。
②该反应中1 mol氧化剂(填“得到”或“失去”)mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是L。
④请把各物质填在下面空格处,需配平:
+□=□+□+□+□
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可表示为:xCuCO3yCu(OH)2zH2O,测定碱式碳酸铜组成的方法有多种.
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3yCu(OH)2zH2O与氢气反应的化学方程式;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→→→→→→(l)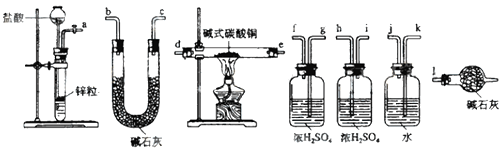
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水.该样品的结晶水质量为 g,化学式为;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是( )
A.等物质的量的H2O与D2O含有的中子数
B.等质量的SO2和SO3中含有氧原子数
C.同温同压下,同体积的CO和NO含有的质子数
D.等物质的量的铁和铝分别于足量氯气完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )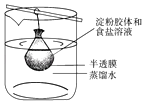
A.烧杯内液体加入硝酸银溶液后有白色沉淀产生
B.烧杯内液体加入碘水后呈蓝色
C.袋内液体加入硝酸银溶液后不会出现白色沉淀
D.袋内液体加入碘水后不变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和铁的各种化合物在日常生活中有着广泛应用,请结合所学知识回答下列问题:
(1)已知1g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24kJ热量,请写出H2S气体燃烧热的热化学方式: .
(2)已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32﹣) 且H2SO3 的电离平衡常数为:K1=1.5×10﹣2 K2=1.1×10﹣7;氨水的电离平衡常数为K=1.8×10﹣2; (i)则等物质的量浓度的下列三种溶液:①NH3H2O ②KHSO3 ③KHCO3 溶液中水的电离程度由大到小排列顺序为
(ii)0.1molL﹣1的NaHSO3溶液中C(H+)C(OH﹣)(“>”、“<”或“=”):
(3)已知25℃时Ksp[Cu(OH)2]=2.2×10﹣20 , Ksp[Fe(OH)2]=8.0×10﹣16 , KspFe(OH)3]=4.0×10﹣38 , Ksp[Al(OH)3]=1.1×10﹣33(i)在25℃下,向浓度均为0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式).
(ii)向1.0mol Fe2(SO4)3和1.0mol FeSO4的1L酸性混合溶液通入NH3 , 至该溶液的PH为3时,所得溶液中c(Fe2+):c(Fe3+)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= . 由水电离出的c(H+)= .
(2)已知MgA2是难溶电解质,则其溶解平衡时的Ksp(MgA2)=;
(3)pH=3的盐酸和pH=3的HA溶液各稀释至其体积的100倍,稀释后盐酸的pH(填“大于”、“小于”或“等于”)HA溶液的pH;
(4)NaA的水溶液显性,原因是(用离子方程式表示).
(5)欲测定某NaOH溶液的物质的量浓度,可用0.1000molL﹣1HA标准溶液进行中和滴定(用酚酞作指示剂).滴定至终点的颜色变化为 . 下列哪些操作会使测定结果偏高(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时,(NH4)2CO3分解的方程式为:(NH4)2CO3 ![]() 2NH3↑+H2O↑+CO2↑,若完全分解,产生的气态混合物的密度是相同条件下氢气密度的( )
2NH3↑+H2O↑+CO2↑,若完全分解,产生的气态混合物的密度是相同条件下氢气密度的( )
A.96倍
B.48倍
C.12倍
D.10倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com