

分析 (1)高温下完全分解为MgO、Al2O3、HCl和水蒸气,根据反应物和生成物书写方程式;
(2)应该首先通过D装置吸收水蒸气,后通过C装置吸收HCl;将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体;
(3)为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸;
(4)根据反应的方程式计算和判断;
解答 解:(1)根据题给信息:高温下完全分解为MgO、Al2O3、HCl和水蒸气,可写出其化学方程式:2[Mg2Al(OH)6Cl•xH2O]$\frac{\underline{\;高温\;}}{\;}$4MgO+Al2O3+2HCl↑+(5+2x)H2O↑,
故答案为:2[Mg2Al(OH)6Cl•xH2O]$\frac{\underline{\;高温\;}}{\;}$4MgO+Al2O3+2HCl↑+(5+2x)H2O↑;
(2)装置C的作用是吸收反应生成的HCl气体,装置D的作用是吸收水蒸气,应该首先通过D装置吸收水蒸气,后通过C装置吸收HCl;将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体,故其连接顺序是a→e→d→b;连接好装置后首先应该检查装置的气密性,
故答案为:a→e→d→b;吸收HCl气体;检查装置的气密性;
(3)因为加热后的装置中含有残留的HCl和水蒸气,为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸,
故答案为:将分解产生的气体全部带入装置C、D中完全吸收;防止产生倒吸;
(4)2[Mg2Al(OH)6Cl•xH2O]$\frac{\underline{\;高温\;}}{\;}$ 4MgO+Al2O3+2HCl↑+(5+2x)H2O↑
73 18×(5+2x)
3.65g 9.90g
解得x=3,
若没有冷却玻璃管,由于气温偏高,装置D不能将水蒸气完全吸收而导致结果偏低,
故答案为:3;偏低.
点评 本题考查化学方程式的书写,主要考查对实验装置和实验流程的理解和熟悉实验操作,同时通过计算,确定水分子数.综合性较强,题目难度较大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | H-H | Br-Br | I-I | H-CL | H-CL | H-I | H-Br |
| 键能 | 436 | 193 | 243 | 431 | 431 | 298 | 366 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
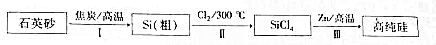
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则溶液中有CO${\;}_{3}^{2-}$ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO${\;}_{4}^{2-}$ | |
| C. | 加入硝酸酸化的硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵、次氯酸钠、醋酸铵、硫酸钡都是强电解质 | |
| B. | 电解、电泳、电离、电化学腐蚀均需在通电条件下才能进行 | |
| C. | 红宝石、水晶、钻石的主要成分都是二氧化硅 | |
| D. | 福尔马林、水玻璃、氨水、胆矾均为混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com