
| A. | 获得新核素${\;}_{113}^{278}$Ja的过程,是一个化学变化 | |
| B. | 题中涉及的三种元素,都属于金属元素 | |
| C. | 这种超重核素${\;}_{113}^{278}$Ja的中子数与质子数只差为52 | |
| D. | 这种新核素,是同主族元素中原子半径最大的 |
分析 A.由30号元素Zn,连续轰击83号元素Bi获得的${\;}_{113}^{278}$Ja属于核变化;
B.Ja、Zn、Bi都是金属元素;
C.${\;}_{113}^{278}$Ja的质子数为113,中子数=278-113=165;
D.${\;}_{113}^{278}$Ja位于第七周期第ⅢA主族.
解答 解:A.由30号元素Zn,连续轰击83号元素Bi获得的${\;}_{113}^{278}$Ja属于核变,故A错误;
B.题中涉及的三种元素Ja、Zn、Bi都是金属元素,故B正确;
C.${\;}_{113}^{278}$Ja的质子数为113,中子数=278-113=165,中子数与质子数差为165-113=52,故C正确;
D.${\;}_{113}^{278}$Ja位于第七周期第ⅢA主族,是同主族元素中原子半径最大的,故D正确;
故选A.
点评 本题考查核素的表示方法和质量数与质子数、中子数的关系,难度不大,注意物理变化、化学变化以及核变化的区别.


科目:高中化学 来源: 题型:选择题
| A. | 食盐可做食物调味剂,也可做食品防腐剂 | |
| B. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法等 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: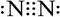 | B. | 镁离子的结构示意图: | ||
| C. | 中子数为16的磷原子:${\;}_{16}^{31}$P | D. | 丙烯的结构简式:CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
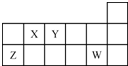
| A. | 原子半径的大小顺序:rZ>rY>rX | |
| B. | Y的简单氢化物水溶液呈酸性 | |
| C. | Y的氢化物与W的氢化物不能发生反应 | |
| D. | X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
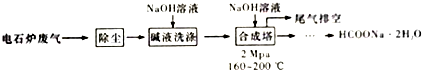
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 表示乙醇燃烧热的热化学方程式(△H的绝对值正确):C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ•mol-1 | |
| B. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| D. | 用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
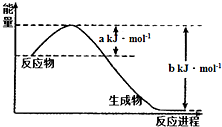 碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响. CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;
CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;| 温度/℃ | n (C)/mol | n(CO2)/mol |
| T1 | 0.3 | |
| T2 | 0.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com