
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P-P键数目为4NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. 1mol FeI2与足量氯气反应时转移的电子数为2NA
D. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为6NA
组成的碳单质中所含质子数一定为6NA
【答案】B
【解析】
A.求出白磷的物质的量,然后根据白磷中含6条p-p键来分析;
B.1个甲烷分子,1个乙烯分子都含有4个H原子;
C.亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气;
D. 13g由![]() C和
C和![]() 组成的碳单质中不一定为1:1混合。
组成的碳单质中不一定为1:1混合。
A.124g白磷的物质的量为1mol,而白磷中含6条p-p键,故1mol白磷中含6NA条p-p键,故A错误;
B.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为:11.2L÷22.4L·mol-1×4×NA=2NA,故B正确;
C.1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故C错误;
D. 13g由![]() C和
C和![]() 组成的碳单质中只有按物质的量比为1:1混合时,所含质子数为6NA,故D错误;
组成的碳单质中只有按物质的量比为1:1混合时,所含质子数为6NA,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是
A. CuI既是氧化产物又是还原产物
B. Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原
C. 每生成1 mol CuI,有12 mol KI发生氧化反应
D. 每转移1.1 mol电子,有0.2 mol![]() 被氧化
被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中有两个关于混合物分离的实验,请回答下列有关问题
实验一:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示

(1)写出下列仪器的名称:①___________ ②_____________
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是______________,将仪器补充完整后进行的实验操作的名称是______________;②的进水口是__________ (填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是___________________
实验二:用CCl4从碘水中萃取I2并分液漏斗分离两种溶液.
其实验操作中有如下两步:
①将漏斗上口玻璃塞打开或使塞上的凹槽或小孔准漏斗的小孔.
②静置分层后,旋开活塞,用烧杯接收下层液体
(4)下层流出的是_____________溶液,上层液体从_________________ 得到(填“上口”或“下口”)
(5)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是(______)
A.不与碘反应
B.碘在其中的溶解度大于在水中的溶解度
C.该萃取剂与水不互溶且密度不同
D.可以选用CCl4、 酒精灯做萃取剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:x A(g)+y B(g) ![]() z C(g)平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol/L,下列判断正确的是
z C(g)平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol/L,下列判断正确的是
A. 平衡向逆反应方向移动B. x+y<z
C. C的体积分数保持不变D. B的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
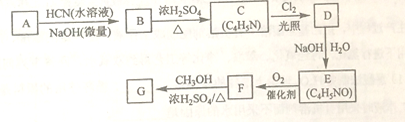
已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②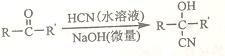
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O来制取NO,当有6.4gCu参加反应时,计算:
(1)用双线桥法标出电子转移的方向和数目;
(2)能生成多少升NO(标准状况下);
(3)使生成的Cu(NO3)2中Cu2+全部转化成沉淀,则至少需要质量分数为40%密度为1.42g/ml的NaOH溶液体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬是一种抗炎、镇痛、解热的常用药,其部分合成路线如下。
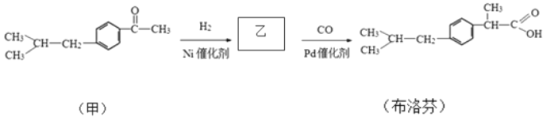
请回答:
(1)乙的结构简式是________________。
(2)布洛芬中含氧官能团的名称是_____________________。
(3)甲 ![]() 乙的反应类型是____________。
乙的反应类型是____________。
(4)布洛芬乙酯是布洛芬粗品精制过程中产生的一种杂质。布洛芬与乙醇,在酸性条件下会生成布洛芬乙酯,该反应的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co、Ni的化合物在生产生活中有着广泛的应用。
(1)![]() 元素在周期表中的位置是4周期,_________族。基态Co原子的电子排布式为____________。
元素在周期表中的位置是4周期,_________族。基态Co原子的电子排布式为____________。
(2)乙二胺NH2-CH2-CH2-NH2(缩写符号en)中N原子的杂化方式为________杂化。en可以与Co形成配合物[Co(en)2Cl2]Cl·HCl·2H2O,配离子结构如下图所示,中心离子的配位数为________,配合物晶体中可能存在的作用力有___________。
A、离子键 B、极性共价键 C、非极性共价键 D、配位键 E、氢键

(3)NiO晶体结构如图1所示,其中离子坐标参数A为(0,0,0),B为(![]() ),则C离子(面心处)坐标参数为_______________。
),则C离子(面心处)坐标参数为_______________。

(4)天然氧化镍晶体中总是存在晶体缺陷,如图2所示。NiXO晶体中x值为![]() ,若晶体中的Ni分别为
,若晶体中的Ni分别为![]() 、
、![]() ,此晶体中
,此晶体中![]() 与
与![]() 的最简整数比为______。
的最简整数比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液,为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00mL甲溶液,向其中缓慢滴加乙溶液15.00mL,共收集到224mL(标准状况)气体
②量取15.00mL乙溶液,向其中缓慢滴加甲溶液25.00mL,共收集到112mL(标准状况)气体
(1)判断:甲是___溶液,其物质的量浓度为___mol/L;
(2)实验②中所发生反应的离子方程式为___。
Ⅱ.将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好能被500mL2.0mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,请计算出NaNO3的物质的量___(要求有计算过程与步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com