

分析 以铜阳极泥(主要成分为Cu、Cu2S、Cu2Se、Cu2Te等)加入焙烧,得到SeO2、SO2、CuO、TeO2等,加入硫酸酸浸,浸出液中含有CuSO4、TeOSO4等,用电解法除去铜,通入二氧化硫,TeOSO4与二氧化硫发生氧化还原反应生成粗碲,以此解答该题.
解答 解:(1)焙烧时通入氧气使铜阳极泥沸腾,类似于冶炼铁的沸腾炉,可增大氧气与铜阳极泥的接触面积,加快反应速率,故答案为:增大氧气与铜阳极泥的接触面积,加快反应速率;
(2)灼烧后得到CuO、TeO2,加入硫酸,生成TeOSO4的同时生成CuSO4,故答案为:CuSO4;
(3)TeOSO4与二氧化硫发生氧化还原反应生成粗碲,方程式为2SO2+TeOSO4+3H2O=Te+3H2SO4,
故答案为:2SO2+TeOSO4+3H2O=Te+3H2SO4;
(4)亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7,可知HSeO3-的水解常数Kh=$\frac{Kw}{{K}_{a2}}$=$\frac{1×1{0}^{-14}}{2.6×1{0}^{-7}}$=0.38×10-7,可知Ka2>Kh,所以NaHSeO3溶液呈酸性,pH<7,
故答案为:<;Ka2=2.6×10-7,Kh=0.38×10-7,可知Ka2>Kh,HSeO3-电离程度大于水解程度,溶液呈酸性;
(5)根据反应的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000 mol/L×0.024L=0.0048mol,
根据关系式计算样品中n(SeO2)=0.0048mol×$\frac{1}{4}$=0.0012mol,故Se的质量为0.0012mol×79g/mol=0.0948g,
所以样品中Se的质量分数为$\frac{0.0948g}{0.1200g}$×100%=79%,
故答案为:79%.
点评 本题考查实验制备方案、氧化还原反应滴定计算、物质的分离提纯、对条件与操作的分析评价,是对学生综合能力的考查,注意题目信息的迁移运用,明确制备流程、发生反应原理为解答关键,题目难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
 世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载.回答下列问題:
世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载.回答下列问題:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
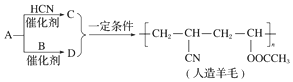
| A. | A生成D的反应属于取代反应 | B. | A生成C的反应属于加成反应 | ||
| C. | 合成人造羊毛的反应属于加聚反应 | D. | 烃A的结构简式为CH≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| C. | Mg+2HCl=MgCl2+H2↑ | |
| D. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子中的4个C-H键完全相等 | B. | CH3Cl 只有1种 | ||
| C. | CH2Cl2不存在同分异构体 | D. | CHCl3不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L苯中含σ键数目为12NA | |
| B. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA | |
| C. | 常温下,1.0L 0.1 mol•L-1 FeCl3溶液中,Fe3+离子数目为0.1NA | |
| D. | O3氧化NO 结合水洗可产生HNO3和O2,每生成1mol HNO3转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,在10mL浓度均为0.1mol/L的NaOH和CH3COONa混合溶液中滴加0.1mol/L的盐酸,所得滴定曲线如图所示.下列说法正确的是( )
25℃时,在10mL浓度均为0.1mol/L的NaOH和CH3COONa混合溶液中滴加0.1mol/L的盐酸,所得滴定曲线如图所示.下列说法正确的是( )| A. | a点溶液加水稀释,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$逐渐增大 | |
| B. | c点时水的电离程度最大 | |
| C. | b→c段发生反应的离子方程式是:CH3COO-+H+=CH3COOH | |
| D. | d点溶液中c(Na+)=c(Cl-)>c(CH3COOH)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰晶石的化学式:Na3AlF6 | |
| B. | 羟基的电子式: | |
| C. | 磷酸的电离方程式:H3PO4?3H++PO43- | |
| D. | 聚丙烯的结构简式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com