
已知:C(s)+H2O(g) CO(g)+H2(g) ΔH = +130 kJ·mol-1
CO(g)+H2(g) ΔH = +130 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=a kJ·mol-1
2CO(g) ΔH=a kJ·mol-1
H—H、O O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
A.-332 B.-118 C.-220 D.+350
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:填空题
(12分)如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O
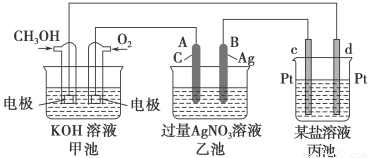
请回答:
(1)甲池是________池,通入O2的电极作为________极,电极反应式为_______________________________________________________________。
(2)乙池是________池,A电极名称为________极,电极反应式为_______________________________________________________________。
乙池中的总反应离子方程式为______________________________________________________________,
溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,充满某气体重124 g,则某气体的相对分子质量为
A.4 B.28 C.32 D.48
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:填空题
(14分)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2.电池的总反应可表示为:4Li+2SOCl2 ===4LiCl +S +SO2
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为__________________;
(2)电池正极发生的电极反应为_____________________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______________________________
(4)组装该电池必须在无水、无氧的条件下进行,原因是______________________.
(5)用此电池电解(电极均为惰性电极)起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,若要使溶液完全恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0 。下列结论中不正确的是
pC(g)+qD(g);△H<0 。下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B 的转化率相等,说明反应开始时,A、B的物质的量之比为 m : n
C.若温度不变时,压强增大到原来的2倍,达新平衡时,总体积一定比原来的1/2要小
D.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列有关能量的判断或表示方法正确的是
A.从C(石墨)=C(金刚石) ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
D.同一个化学反应,化学计量数不同,ΔH的值不同;化学计量数相同而状态不同,ΔH的值也不同。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
某学生做中和滴定实验的过程如下:
a.取一支碱式滴定管;
b.用蒸馏水洗净;
c.加入待测 NaOH溶液;
d.记录液面刻度读数;
e.用酸式滴定管精确放出一定量标准酸液;
f.置于未经标准酸液润洗的洁净锥形瓶中;
g.加入适量蒸馏水;
h.加入酚酞试液2滴;
i.滴定时,边滴边摇动;
j.边注视滴定管内液面的变化;
k.当刚滴到溶液由无色变成粉红色时,即停止滴定;
l.记录液面读数;
m.根据滴定管的两次得出NaOH溶液的体积为22mL。
上述实验过程中的错误之处有:
A.f.g.k.m B.c.j.k.m C.c.h.i.k D.f.g.h.j.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:填空题
(13分)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 | 温度 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com