
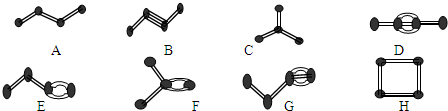
分析 A为正丁烷,B为2-丁烯,C为异丁烷,D为2-丁炔,E为1-丁烯,F为2-甲基-1-丙烯,G为1-丁炔,H为环丁烷,
(1)碳原子之间以单键连接成链状的为链状烷烃;
(2)上图中的化合物中,碳原子的成键方式为碳原子与碳原子之间可形成单键、双键、三键,可以成链也可以成环;
(3)分子式相同,结构不同的化合物互为同分异构体,考虑碳链异构、位置异构、官能团异构;
(4)D为2-丁炔,官能团为碳碳三键.
解答 解:(1)A(正丁烷)和C(异丁烷)属于链状烷烃,B(2-丁烯)、E(1-丁烯)、F(2-甲基-1-丙烯)属于链状烯烃,D(2-丁炔)和G(1-丁炔)属于链状炔烃,H(环丁烷)属于脂环烃,
故答案为:AC;
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价键,还可以形成双键和三键;不仅可以形成碳链,还可以形成碳环,
故答案为:双键;三键;碳链;
(3)分子式相同,结构不同的化合物互为同分异构体,A(正丁烷)和C(异丁烷)互为同分异构体,B(2-丁烯)和E(1-丁烯)、F(2-甲基-1-丙烯)、H(环丁烷)互为同分异构体,D(2-丁炔)和G(1-丁炔)互为同分异构体,
故答案为:C;E、F、H;G;
(4)D为2-丁炔,官能团为碳碳三键,
故答案为:碳碳三键.
点评 本题考查了有机物的结构和同分异构体现象,难度不大,能够根据有机物中碳原子的成键情况得出其名称是关键,同分异构体注意考虑碳链异构、位置异构、官能团异构.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题
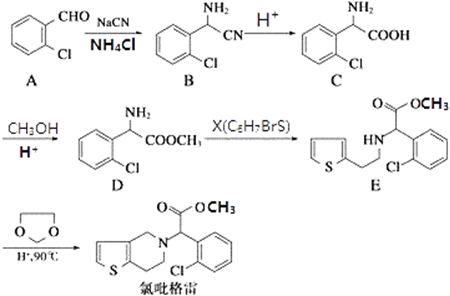

 .(不需要写反应条件)
.(不需要写反应条件) ②
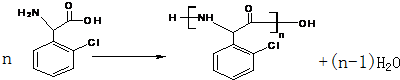
② 中氯原子较难水解,物质A(
中氯原子较难水解,物质A(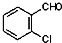 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
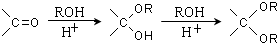
、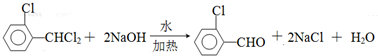 .
.
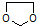 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2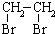
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6+Cl2→C2H5Cl+HCl | B. | CH2═CH2+H2O→CH3CH2OH | ||
| C. |  +HO-NO2→ +HO-NO2→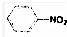 +H2O +H2O | D. | CH3CH2Cl+NaOH→CH2═CH2+NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{1}{2}$ | |
| B. | 向酒精灯里添加酒精,不可超过酒精灯容积的$\frac{2}{3}$ | |
| C. | 酒精灯使用完毕,应立即用嘴吹灭火焰 | |
| D. | 用燃着的酒精灯去点燃另一盏酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液加入等质量的锌粉,产生氢气的速率相同 | |
| B. | 两溶液中氢氧根离子浓度均为10-13 mol/L | |
| C. | 加入醋酸钠固体,二者的pH均增大 | |
| D. | 恰好完全反应时,二者消耗氢氧化钠的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.
氮元素可形成多种金属氮化物,如氮化钠(Na3N)、氮化镁(Mg3N2)和叠氮化钠(NaN3)等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
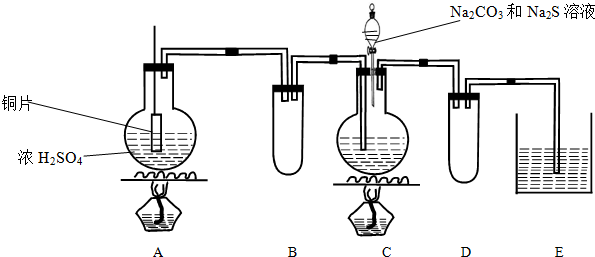
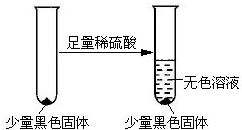
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将“地沟油”反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 | |
| B. | 红宝石、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| C. | 科学家推测月尘[即月球上直径小于10微米(1μm=1×10-6m)的浮尘]是“玉兔号”出现控制异常情况的主要原因,月尘在空气中形成的分散系不属于胶体 | |
| D. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com