
【题目】下列说法正确的是( )
A.物质的溶解性为难溶,则该物质不溶于水
B.不溶于水的物质溶解度为0
C.绝对不溶解的物质是不存在的
D.某离子被沉淀完全是指该离子在溶液中的浓度为0
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生 的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
请冋答下列问题:
(1)反应I能够自发进行的条件是____________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应II的Kp="___________" (用表达式表示)。
(3)假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是______________。

(4)通过监测反应体系中气体浓度的变化判断反应I和II是否同时发生,理由是___________。
(5)图I为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有__________。
A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数 D.提高反应体系的温度
(6)恒温恒容条件下,假设反应I和II同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)
随时间t变化的总趋势图。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由甲醇、氧气和强碱溶液(作电解质)组成的新型手机电池,可持续使用一个月,其电池反应为:2CH3OH+3O2+4OH-![]() 2CO32-+6H2O,则有关说法正确的是( )
2CO32-+6H2O,则有关说法正确的是( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH--6e-=CO32-+6H2O
C.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨基酸和蛋白质的叙述,错误的是( )
A. 甲硫氨酸的R基是-CH2-CH2-S-CH3,则它的分子式是C5H11O2NS
B. 分子式为C63H105O45N17S2的多肽化合物中,最多含有肽键17个
C. 两个氨基酸脱水缩合过程中失去的H2O中的氢来源于氨基和羧基中的氢
D. 如果有足量的三种氨基酸甲、乙、丙,则他们能形成三肽种类最多有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活必需品,也是重要的化工原料。
(1)某种粗盐含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯该粗盐的流程如下:
粗盐溶解![]()
![]() 滤液
滤液![]()
![]() 纯NaCl
纯NaCl
提供的试剂有:a.饱和Na2CO3溶液 b.饱和K2CO3溶液 c.NaOH溶液 d.BaCl2溶液 e.Ba(NO3)2溶液
欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,需依次加入三种试剂,顺序依次为
(填序号); ;
(2)食盐是工业上生产氯气和烧碱的重要原料。下图是工业上电解饱和食盐水的离子交换膜电解槽示 意图(阳极用金属钛网制成,阴极由碳钢网制成)。
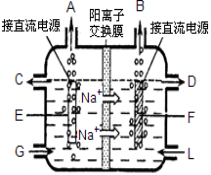
①F电极是 (填阴极或阳极);G处进口的物质是 ;
电解总反应的离子方程式为: 。
②通电几分钟后,如果将直流电源的正负极与电极接反,在电极F附近可以观察到的现象是 。
(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液,制取消毒液的离子反应方程式为 ,当收集到22.4L标准状况下的H2时,理论上所得混合溶液中次氯酸钠的质量最多为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )

A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
I.汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
(1)在T1、T2温度下,一定量的NO发生分解反应时N2 的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H__________0(填“>"或“ <”)。
2NO(g)的△H__________0(填“>"或“ <”)。

(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)_________。该温度下,若增大压强此反应的平衡常数将____________(填“增大”、“减小”、“不变”或“无法确记”);若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后O2的转化率为__________。
II.甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
(3)甲醇燃料电池(简称DMFC )由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如右图所示:
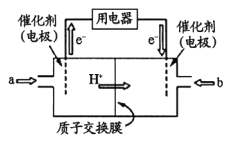
通入a气体的电极是原电池的____________极(填“正”或“负”),其电极反应式为_______________。
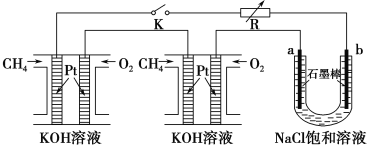
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量为0.224L (标况),且反应完全,则理论上通过电解池的电量为 __________(法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:

A.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30min,冷却得墨绿色熔渣(主要成分为K2MnO4);
B.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
C.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:加热浓缩、冷却结晶、过滤、____________、干燥。该操作为如何进行___________________。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com