
| 选项 | 实验现象 | 结论 |
| A | 将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
| B | 某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定存在SO42- |
| C | 滴有酚酞的Na2CO3溶液中加入BaCl2固体,红色变浅 | Na2CO3溶液中存在水解平衡 |
| D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、2H2+O2
| ||||
B、2CH3OH+3O2
| ||||
| C、Zn+2HCl═ZnCl2+H2↑ | ||||
| D、NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100kPa |
5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
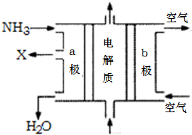 工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中加入少量氢氧化镁固体:Mg(OH)2+2CH3COOH═Mg2++2CH3COO-+2H2O |
| B、H2O2溶液中加入足量酸性KMnO4溶液:2MnO4-+3H2O2+6H+═2Mn2++6H2O+4O2↑ |
| C、Ca(HCO3)2溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| D、NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10g NH3含有4NA个电子 |
| B、0.1mol铁和0.1mol铜分别与0.1mol氯气完全反应,转移的电子数均为0.2NA |
| C、标准状况下,22.4L H2O中分子数为NA个 |
| D、1L 0.1mol?L-1 Na2CO3溶液中含有0.1NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
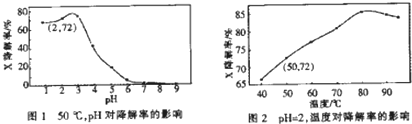
| A、50℃,PH在3~6之间,X降解率随PH增大而减小 |
| B、PH=2,温度在40~80℃,X降解率温度升高而增大 |
| C、无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80℃ |
| D、PH=2、温度为50℃,10min内v(X)=1.44×10-4mol?L-1min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚钠溶液中通入少量的C02气体:C02+H20+2C6H5O-→C6H50H+2C032- | |||
B、在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2=CH2+H20
| |||
C、葡萄糖溶液与碱性氢氧化铜悬浊液混合后水浴加热:C6H12O6+2Cu(OH)2+NaOH
| |||
D、2分子甘氨酸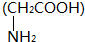 脱去2分子水: 脱去2分子水: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com