
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | AlCl3溶液呈酸性:Al3++3H2O→Al(OH)3+3H+ | |
| C. | Al2(SO4)3溶液加入过量的氨水:Al3++3 NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O |
分析 A.离子方程式两边总电荷不相等,违反了电荷守恒;
B.铝离子的水解为可逆反应,应该用可逆号;
C.硫酸铝与氨水反应生成氢氧化铝沉淀和硫酸铵;
D.碳酸氢钙少量,反应生成碳酸钙沉淀、碳酸钠和水.
解答 解:A.FeCl2溶液中通入Cl2,二者发生氧化还原反应,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.AlCl3溶液中,铝离子部分水解生成氢氧化铝和氯化氢,溶液呈酸性,正确的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故B错误;
C.Al2(SO4)3溶液加入过量的氨水,反应生成氢氧化铝沉淀和硫酸铵,反应的离子方程式为:Al3++3 NH3•H2O=Al(OH)3↓+3NH4+,故C正确;
D.NaOH溶液中滴加少量Ca(HCO3)2溶液,反应生成碳酸钙、碳酸钠和水,正确的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 上述反应均属于氧化还原反应 | |
| B. | 生成1 mol Cl2时,三个反应中转移的电子数相等 | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置量取 15.00ml 的 NaOH 溶液 | |
| B. |  用装置制备 Cl2 | |
| C. |  装置用于除去 CO2中的HCl | |
| D. |  关闭活塞 a,从 b处加水,以检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2不能转化为Ca(OH)2 | B. | Ca(OH)2的溶解度最小 | ||
| C. | Ca(OH)2不能转化为 Mg(OH)2 | D. | Ksp越大,S不一定越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
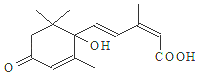 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1mol该物质与H2加成,最多消耗5molH2 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶和分液漏斗使用前必须要检漏、干燥 | |
| B. | 可以用酒精萃取溶解在水中的碘 | |
| C. | 新制氯水应保存在棕色细口瓶中 | |
| D. | 某溶液焰色反应呈黄色,说明溶液中含有Na+,不含K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
| 实验方案 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com