
| A、60% | B、40% |
| C、24% | D、4% |
| x2 |
| (3-x)(2-x) |
| 1.2mol |
| 2mol |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
 氮族元素的单质及其化合物的应用较为广泛.请回答下列问题:
氮族元素的单质及其化合物的应用较为广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol?L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
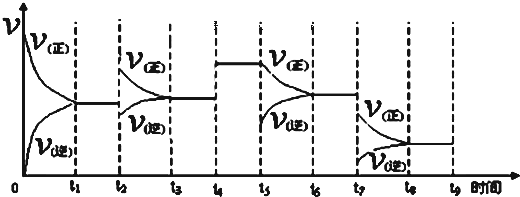
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO在平衡时转化率为10% |
| B、平衡浓度c(CO2)=c(H2) |
| C、平衡时气体平均相对分子质量约为23.3 |
| D、其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应放出热量x=0.05a |
| B、反应达到平衡状态时,2v(SO2)消耗=v(O2)生成 |
| C、若恒温恒压下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,平衡后反应放出的热量y kJ,则y<x |
| D、升高温度,平衡常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应物浓度,能增大活化分子百分数,所以反应速率增大 |
| B、使用正催化剂,能增大活化分子百分数,所以反应速率增大 |
| C、对于任何反应,增大压强都可加快反应速率 |
| D、升高温度,只能增大吸热反应的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中铜和铁共0.15mol |
| B、稀硝酸的物质的量的浓度为2mol.L-1 |
| C、第一次剩余4.8g金属为铜 |
| D、再加足量的稀硫酸,又得到标准状况下6.72LNO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li、Be、B原子最外层电子数依次增多 |
| B、P、S、C1元素最高正价依次升高 |
| C、N、O、F原子半径依次增大 |
| D、Na、K、Rb的电子层数依次增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com