
| A. | CH4分子的比例模型: | B. | 硫原子的结构示意图: | ||
| C. | 溴化钠的电子式: | D. | CO2的电子式: |
分析 A.甲烷分子中,碳原子的相对体积大于H原子,且为正四面体结构;
B.硫原子的核电荷数=核外电子总数=16,最外层为6个电子;
C.溴化钠为离子化合物,阴阳离子需要标出所带电荷;
D.二氧化碳分子中含有两个碳氧双键.
解答 解:A.甲烷为正四面体结构,碳原子半径大于氢原子,甲烷的比例模型为 ,故A正确;
,故A正确;
B.硫原子的质子数是16,最外层电子数为6,正确的原子结构示意图为: ,故B错误;
,故B错误;
C.溴化钠为离子化合物,由钠离子和溴离子构成,电子式为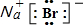 ,故C错误;
,故C错误;
D.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、原子结构示意图、比例模型等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 电离平衡常数受溶液浓度的影响 | |
| B. | 电离平衡常数不可以表示弱电解质的相对强弱 | |
| C. | 电离常数越大的酸,其溶液的 c(H+)一定越大 | |
| D. | H2CO3的第一步电离的电离常数表达式:K=$\frac{c({H}^{+})•c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | HCl的水溶液中存在H+和Cl- | HCl是离子化合物 |
| ② | NO2通入水中,发生反应,产物中有HNO3 | NO2是酸性氧化物 |
| ③ | 向FeCl3溶液中加入铜片,溶液逐渐变为蓝色 | 氧化性:Fe3+>Cu2+ |
| ④ | 等物质的量的Na和Al都完全反应,Al失电子多 | 金属性:Al>Na |
| ⑤ | 某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①② | B. | ①②④ | C. | ③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- | |
| B. | 加入稀盐酸产生能使澄清石灰水变浑浊的无味气体,则溶液中一定有CO32- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 做焰色反应,末观察到焰色为紫色,则待测液中一定不含有钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解铝工业中添加冰晶石 | |
| B. | 开发太阳能、风能、氢能等清洁能源 | |
| C. | 收集废弃的秸杆等生产沼气 | |
| D. | 为防止电池中的重金属污染土壤,将废旧电池深埋地下 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$Fe(OH)3(胶体) | |
| B. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{HCl(aq)}{→}$AlCl3 | |
| C. | FeS2$\frac{\underline{\;燃烧\;}}{\;}$SO3$\frac{\underline{\;H_{2}O\;}}{\;}$H2SO3 | |
| D. | 饱和NaCl(aq)$\frac{\underline{\;NH_{3}CO_{3}\;}}{\;}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com