
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
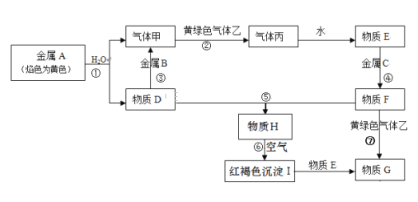
(1)写出下列物质的化学式:B__________,丙__________,乙__________,H__________
(2)根据要求回答:
①D溶液和F溶液在空气中混合的现象__________;
②)反应③离子方程式__________;
③反应⑦离子方程式__________;
【答案】Al HCl Cl2 Fe(OH)2 产生白色沉淀迅速变成灰绿色,最后变为红褐色 2Al+2OH-+2H2O =2AlO2-+3H2↑ 2Fe2++Cl2=2Cl-+2Fe3+
【解析】
金属A焰色反应为黄色,说明A为Na;钠与水反应生成氢氧化钠和氢气,则气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应生成氢气,说明B为Al;黄绿色气体乙为Cl2,与氢气反应生成的丙为HCl,溶于水得到的E为盐酸;物质D(氢氧化钠)和G反应生成的红褐色沉淀H为Fe(OH)3,说明G中含有Fe3+,金属C与盐酸反应得到F,F与氯气反应得到G,可推知C为Fe,F为FeCl2,G为FeCl3。
(1) 根据上述分析知道物质B的化学式: Al,丙为HCl, 乙为Cl2, H为Fe(OH)3;答案:Al、HCl、Cl2、Fe(OH)2。
(2) ①根据上述分析知道D为氢氧化钠溶液,F为FeCl2溶液在空气中混合发生反应为FeCl2+2NaOH= Fe(OH)2![]() +2NaCl,生成白色Fe(OH)2沉淀不稳定,在空气中迅速变成灰绿色,最后变为红褐色;答案:产生白色沉淀迅速变成灰绿色,最后变为红褐色。
+2NaCl,生成白色Fe(OH)2沉淀不稳定,在空气中迅速变成灰绿色,最后变为红褐色;答案:产生白色沉淀迅速变成灰绿色,最后变为红褐色。
②)反应③为物质D和金属B反应,根据分析D为氢氧化钠溶液,金属B为Al,两者反应的离子方程式2Al+2OH-+2H2O =2AlO2-+3H2↑;答案:2Al+2OH-+2H2O =2AlO2-+3H2↑。
③反应⑦为物质F和乙反应, 根据分析F为FeCl2溶液,乙为Cl2,两者反应的离子方程式2Fe2++Cl2=2Cl-+2Fe3+;答案:2Fe2++Cl2=2Cl-+2Fe3+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置,下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为: Fe2e===Fe2+
C. a和b用导线连接时,电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法不正确的是
![]()
A. 最简单的氢化物的沸点:X>W
B. 元素的非金属性:Z>W>Y
C. 简单离子的半径大小:Y>W>Z
D. 氧化物对应水化物的酸性:Y<W<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质![]() 经如图所示的过程转化为含氧酸
经如图所示的过程转化为含氧酸![]() ,已知
,已知![]() 为强酸,请回答下列问题:
为强酸,请回答下列问题:
![]()
(1)若![]() 在常温下为固体,
在常温下为固体, ![]() 是能使品红溶液褪色的有刺激性气味的无色气体。
是能使品红溶液褪色的有刺激性气味的无色气体。
①![]() 的化学式是__________。
的化学式是__________。
②在工业生产中, ![]() 气体的大量排放被雨水吸收后形成了__________而污染了环境。
气体的大量排放被雨水吸收后形成了__________而污染了环境。
(2)若![]() 在常温下为气体,
在常温下为气体, ![]() 是红棕色的气体。
是红棕色的气体。
①![]() 的化学式是__________。
的化学式是__________。
②![]() 的浓溶液在常温下可与铜反应并生成
的浓溶液在常温下可与铜反应并生成![]() 气体,请写出该反应的化学方程式________________。
气体,请写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳酸钠俗称纯碱,可作为碱使用的原因是__________________(用离子方程式表示)。
(2)25℃时,pH均为11的 NaOH 溶液和Na2CO3溶液中,水电离的OH-浓度之比是_____
(3)在0.1 mol·L-1的Na2CO3溶液中,下列粒子浓度关系式正确的是________。
A.[CO32-]+[HCO3-]=0.1 mol·L-1
B.[CO32-]+[HCO3-]+[H2CO3]=0.1 mol·L-1
C.[OH-]=[H+]+[HCO3-]
D.[Na+]+[OH-]=[H+]+[HCO3-]
(4)常温下0.1 mol·L-1的Na2CO3溶液中,离子浓度由大到小的顺序是__________________________________。
(5)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() =__________。(已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010,结果保留一位小数)
=__________。(已知Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010,结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在加热下与足量氧气充分反应,第二块在常温下与足量氧气充分反应。则下列说法正确的是( )
①两块钠失去电子一样多 ②第一块钠失去电子多 ③第二块钠失去电子多
④两块钠的反应产物质量一样大 ⑤第一块钠的反应产物质量大
⑥第二块钠的反应产物质量大
A. ①④ B. ②⑤ C. ③⑥ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的示意图如图所示。下列说法正确的是
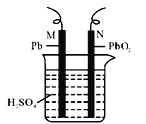
A. 放电时,N为负极,其电极反应式:PbO2+SO42-+4H++2e-=PbSO4+2H2O
B. 放电时,c(H2SO4)不变,两极的质量增加
C. 充电时,若N连电源正极,则该极生成PbO2
D. 充电时,阳极反应式:PbSO4+2e-=Pb+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)11.2g铁的物质的量
(2)所用盐酸中HCl的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池装置如图,电解液在电解质储罐和电池间不断循环。下列说法错误的是
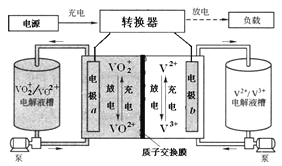
A. 充电时,氢离子通过交换膜移向右侧
B. 充电时,电源负极连接a电极
C. 放电时装置发生的总反应为:VO2++V2++2H+=VO2++V3++H2O
D. 质子交换膜可阻止VO2+与V2+直接发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com