
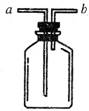
 现有如图所示装置,为实现下列实验目的
现有如图所示装置,为实现下列实验目的分析 图中为多用瓶,干燥或除杂气体时导管长进短出,a进入可收集密度比空气密度大的气体,b进入可收集密度比空气密度小的气体,或装满水b进入收集不溶于水的气体,且可作为防止倒吸装置来使用,以此来解答.
解答 解:A、瓶内盛液体干燥剂,用以干燥气体.作为入口的是a,故答案为:a;
B、瓶内盛液体洗剂,用以除去某气体中的杂质.作为入口的是a,故答案为:a;
C、瓶内盛水,用以测量某难溶于水的气体体积.作为入口的是b,故答案为:b;
D、瓶内贮存气体,加水时气体可被排出.作为入口的是b,故答案为:b;
E、收集密度比空气大的气体.作为入口的是a,故答案为:a;
F、收集密度比空气小的气体.作为入口的是,故答案为:b;
G、作为安全瓶,防止实验过程中液体倒吸.作为入口的是b,故答案为:b.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的收集、倒吸装置、除杂等,把握实验装置的作用为解答的关键,侧重分析与应用能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮能使织物褪色,对金属材料也有腐蚀作用 | |
| B. | 亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 | |
| C. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| D. | 大量燃烧化石燃料是造成雾霾天气的重要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
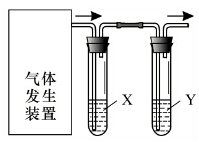 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( ) | 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
| B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
| C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L CO的质量小于1 L O2的质量 | |
| B. | 常温下9 g H2O中所含原子数为1.5NA | |
| C. | 含1 mol FeCl3的溶液水解后生成的氢氧化铁胶体粒子的数目为NA | |
| D. | OH-的摩尔质量为17 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com