
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。关于这两种晶体的说法正确的是
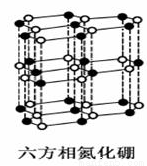
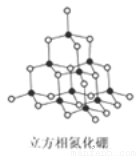
A.两种晶体均为原子晶体
B.立方相氮化硼含有σ键和π键,所以硬度大
C.六方相氮化硼层结构与石墨相似却不导电的原因是层状结构中没有自由移动的电子
D.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1mol NH4BF4含有1 mol配位键
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:简答题
二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C=O | O=O | C—C |
键能(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g) CH3CHO(g)+H2O(g)△H1=____________。
CH3CHO(g)+H2O(g)△H1=____________。
②若2CH3CHO(g)+O2(g) 2CH3COOH(g)反应可自发进行,
2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g) CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
(2)将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g) 2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。

(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)= 1.75×10-5,  ≈1.3,lgl.3≈0.1
≈1.3,lgl.3≈0.1
①25℃,0.lmol·L-1CH3COOH 溶液的pH =______;将0.1 mol·L-1CH3COOH溶液与0.1mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为__________________。
②25℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=_____ (保留2位有效数字)。
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
已知:a、b、c三物质间有如下转化关系a→b→c→a,物质间转化均只需要一步反应便能完成,则a、b、c不可能是( )
A. a:Fe b:FeCl3 c:FeCl2 B. a:AlCl3 b:Al(OH)3 c:Al2O3
C. a:N2 b:NH3 c:NO2 D. a:SO2 b:SO3 c:H2SO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列各组物质与用途关系不正确的是( )
A. 过氧化钠:供氧剂 B. 二氧化硅:半导体
C. 明矾:净水剂 D. 三氧化二铁:红色油漆
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:简答题
I.铬单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子轨道表示式为________________;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于_________________。
(2)配合物CrCl3·6H2O的配位数为6,它有三种不同组成、不同颜色的固体,其中一种为浅绿色固体,该固体与足量硝酸银溶液反应时,0.5mol固体可生成1mol氯化银沉淀,则这种浅绿色固体的配体个数比(Cl-:H2O)为_____________。
II.砷化镓为第三代半导体材料,晶胞结构如图所示:
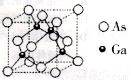
(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为__________。
(4)AsH3分子的立体构型为__________,其中As原子的杂化方式是______。1个(CH3)3Ga分子中含有_________个σ键,砷的第一电离能_______(填“>”或“<”)镓的第一电离能。
(5)砷化镓晶休中砷和镓的最近原子核间距为a nm,砷化镓的摩尔质量为bg·mol-1,阿伏加德罗常数值为NA,则砷化镓晶体的密度表达式是_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次增大,其中Y元素的原子半径最大。已知A、B、C分别是X、Y、Z三种元素的单质,A和C常温下为气体。在适宜的条件下,A、B、C可以发生如图所示的反应。下列说法正确的是
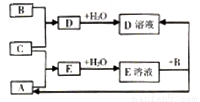
A. 化合物YX中含离子键 B. Z的含氧酸均为强酸
C. 非金属性:X>Z D. 离子半径:Y>Z
查看答案和解析>>
科目:高中化学 来源:2017届江西省九江市十校高三第二次联考理科综合化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.5molCu与足量的S反应转移电子数为NA
B. 在粗铜精炼的实验中,阳极质量减小6.4g,则电解过程中转移电子数为0.2N A
A
C. 2gD2O和H218O的混合物中含有的中子数为NA
D. 46g有机物C2H6O中含有极性共价键的数目一定为7NA
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:简答题
二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) ∆H1
CH3OCH3(g)+H2O(g) ∆H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) CH3OH(g) ∆H2=-90.7 kJ·mol-1
CH3OH(g) ∆H2=-90.7 kJ·mol-1
③2CH3OH(g) CH3OCH3(g)+H2O(g) ∆H3
CH3OCH3(g)+H2O(g) ∆H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如下:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
则∆H1=__________kJ·mol-1、∆H3=__________kJ·mol-1
(2)反应①的化学平衡常数表达式为_____________。
制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______________。
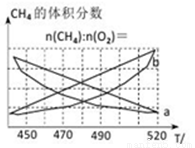
下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=_____________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com