
| A. | 电解硫酸时,阴极产生 1molH2时,阳极一定产生 0.5molO2 | |
| B. | 盛有 SO2 的密闭容器中含有 NA 个氧原子,则 SO2 的物质的量为 0.5mol | |
| C. | 电解 1mol 熔融的 Al2O3,能产生 33.6L 氧气、54.0g 金属铝 | |
| D. | 工业用电解法进行粗铜精炼时,每转移 1mol 电子,阳极上就溶解 0.5NA 个铜原子 |
分析 A.电解硫酸时,若为惰性电极阴极生成氢气,阳极生成氧气,且由转移电子可计算生成气体的物质的量;
B.结合n=$\frac{N}{{N}_{A}}$及分子构成计算;
C.发生2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,由V=nVm、m=nM计算,但气体状况未知;
D.工业用电解法进行粗铜精炼时,比Cu活泼的金属先失去电子.
解答 解:A.电极材料未知,阳极不一定生成气体,且转移电子未知,不能计算生成气体的物质的量,故A错误;
B.盛有SO2的密闭容器中含有NA个氧原子,n(O)=1mol=2n(SO2),则SO2的物质的量为0.5mol,故B正确;
C.发生2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,则电解1mol熔融的Al2O3,能产生1.5mol氧气、2molAl,即54.0g金属铝,但气体状况未知,不能计算氧气的体积,故C错误;
D.工业用电解法进行粗铜精炼时,比Cu活泼的金属先失去电子,则每转移1mol电子,阳极上溶解少于0.5NA个铜原子,阴极上就生成0.5NA个铜原子,故D错误;
故选B.
点评 本题考查物质的量的计算,为高频考点,把握电解原理、电解反应及物质的量的计算为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{△{H}_{1}}{△{H}_{2}}$mol | B. | $\frac{2△{H}_{1}}{△{H}_{2}}$mol | C. | $\frac{△{H}_{1}}{2△{H}_{2}}$mol | D. | -$\frac{△{H}_{1}}{2△{H}_{2}}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①可用于实验室制备少量Cl2或NH3 | |
| B. | 可用从a处加水的方法检验装置②的气密性 | |
| C. | 实验室也可以用装置③收集HCl气体 | |
| D. | 装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们最熟悉的液态金属是水银,因其价格太贵而限制了实际应用 | |
| B. | 液态金属中存在的粒子有金属阳离子和自由电子,它们之间通过静电作用形成离子键 | |
| C. | 铝在液态金属中燃烧放出热量从而提供能量,使液态金属实现高速、高效的长时运转 | |
| D. | 液态金属机器“吞食”铝片后,在电解质里形成原电池反应,会产生电力和气泡,从而产生动力 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减压 | B. | 升温 | ||
| C. | 加压 | D. | 从体系中分离出一部分B物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
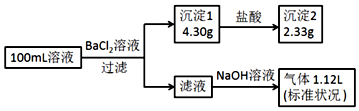
| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-和Na+ | |
| C. | 原溶液中c(Cl-)≥0.2mol•L-1 | |
| D. | 若原溶液中c(NH4+)=0.05mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com