
【题目】如图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1,B为常见液体。
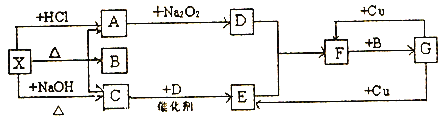
试回答下列问题:
(1)X是_____;F是____。(写化学式)
(2)写出C→E反应的化学方程式并用双线桥标出电子转移的方向和数目__________。
(3)G与Cu的反应中,G表现_______性质。
(4)写出X→A的离子方程式:__________。
(5)以C、B、D为原料可生产G,若使amolC的中心原子完全转化到G中,理论上至少需要D___mol。
【答案】NH4HCO3 NO2  酸性和氧化性 H++HCO3﹣==H2O+CO2↑ 2a
酸性和氧化性 H++HCO3﹣==H2O+CO2↑ 2a
【解析】
X能与盐酸、氢氧化钠反应都生成气体,X应为弱酸的铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(氨气)与D(氧气)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G,G能与Cu反应生成NO、NO2,则G为HNO3。
(1).由上述分析可知,X是NH4HCO3;F是NO2,故答案为:NH4HCO3;NO2;
(2).氨气与氧气反应生成NO和水,在该反应中,氮元素的化合价从-3价升高到+2价,氧元素的化合价从0价降低到-2价,根据得失电子守恒和原子守恒,用双线桥法表示该反应的式子为: ,故答案为:
,故答案为: ;
;
(3). Cu与硝酸反应生成硝酸铜、氮的氧化物和水,反应中N元素的化合价部分未发生变化,部分降低,则硝酸表现酸性、氧化性,故答案为:酸性和氧化性;
(4). NH4HCO3与盐酸反应生成氯化铵、二氧化碳和水,该反应的离子方程式为:H++HCO3-==H2O+CO2↑,故答案为:H++HCO3-==H2O+CO2↑;
(5)以NH3、H2O、O2为原料可生产HNO3,使amolNH3完全转化为HNO3,根据得失电子守恒,理论上至少需要氧气的物质的量=![]() =2amol,故答案为:2a。
=2amol,故答案为:2a。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】关于金属腐蚀,下列说法正确的是
A. 金属的化学腐蚀比电化学腐蚀更普遍
B. 析氢腐蚀比吸氧腐蚀更普遍
C. 析氢腐蚀后阶段会发生吸氧腐蚀
D. 牺牲阳极的阴极保护法是利用了电解原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把对应物质的字母代码填入括号内.
A.水玻璃 B.明矾 C.浓硫酸 D.过氧化钠 E.新制氯水 F.小苏打 G次氯酸钙
①能使石蕊试液先变红后褪色___________。
②能做木材防火剂___________。
③能做处理胃酸过多的一种药剂____________。
(2)综合考虑经济、技术、环保等方面因素,设计以铜为原料制取硫酸铜的最佳路线图。如:![]()
路线图为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18.4mol/L的浓H2SO4配制100mL浓度为1.0mol/L的稀H2SO4,其操作可分为以下各步:
(1)A.用量简量取_____浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注人容量瓶中;
C.将稀释后的H2SO4小心转移到100mL容量瓶里;
D.检查100mL容量瓶口部是否会发生滴漏;
E.加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平。
(2)上述操作正确的顺序为(用字母填写)__________。
(3)进行A步操作时,应选择下列量器_______(填序号)。
a.10mL量筒 b.50mL量筒 c.100mL量筒
(4)如果对装有浓H2SO4的量筒读数如右图所示,配制的稀H2SO4的浓度将_______(偏高、偏低、无影响)。
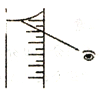
(5)进入A步操作后,必须________后才能进行C操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家在青蒿素应用领城取得重大进展,如利用下述反应过程可以制取治疗疟疾的首选药青蒿琥酯。下列有关说法正确的是
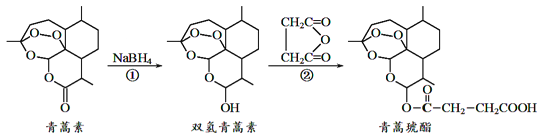
A. 青蒿素分子中所有碳原子在同一平面内
B. 反应①属于还原反应,反应②理论上原子利用率可达100%
C. 双氢青蒿素属于芳香族化合物
D. 青蒿琥酯可以发生水解、酯化以及加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________。
(2)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体分子__________,三角锥形分子__________,V型分子__________。
(3)已知白磷(P4)的结构为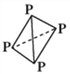 ,可知每个磷原子以___个共价键与另外的___磷原子结合成正四面体结构,它应该是________分子(填“极性”或“非极性”),在CS2中______(填“能”或“不能”)溶解,P原子的杂化方式为______________。
,可知每个磷原子以___个共价键与另外的___磷原子结合成正四面体结构,它应该是________分子(填“极性”或“非极性”),在CS2中______(填“能”或“不能”)溶解,P原子的杂化方式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com