
【题目】将少量的CO2通入下列溶液中,不变浑浊的是
A.偏铝酸钠溶液 B.CaCl2溶液 C.澄清石灰水 D.硅酸钠溶液
科目:高中化学 来源: 题型:
【题目】右图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是
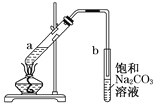
A. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C. 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使反应向生成乙酸乙酯的方向移动
D. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有CuO、Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液、稀硫酸七种物质,在常温下两种物质两两间能发生反应最多有
A.4个 B.5个 C.6个 D.7个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时1体积某气态烃和4体积O2混合,完全燃烧后恢复到原来的温度和压强时,体积不变,该分子式中所含的碳原子数不可能是
A. 1 B. 2 C. 3 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的热点。
(1) NaBH4是一神重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________,反应消耗1molNaBH4时转移的电子数目为___________。
(2) H2S热分解可制氢气。反应方程式:2H2S(g)=2H2(g)+S2(g) △H;在恒容密闭容器中,测得H2S分解的转化率(H2S起始浓度均为c mol/L)如图1所示。图l中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。

①△H ______0(填“>”“<”或“=”);
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=_____(用含c、t的代数式表示);
③请说明随温度升高,曲线b向曲线a接近的原因____________。
(3) 使用石油裂解的副产物CH4可制取H2,某温度下,向体积为2L的密闭容器中充入0.40mol CH4(g)和0.60molH2O(g)的浓度随时间的变化如下表所示:

①写出此反应的化学方程式_________,此温度下该反应的平衡常数是_________。
②3 min时改变的反应条件是_________(只填一种条件的改变)。
③一定条件下CH4的平衡转化率与温度、压强的关系如图2所示。则P1_________P2填“>”、“<”或“=“)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲制备漂白剂亚氯酸钠(NaClO2)。甲同学通过查阅文献发现:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
实验I 乙同学利用下图所示装置制取NaClO2晶体
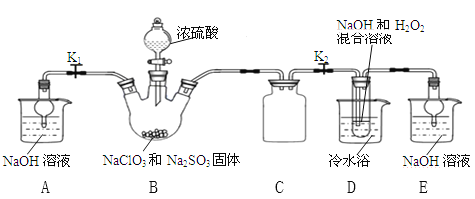
(l)装置B中使浓硫酸顺利滴下的操作是______,该装置中生成了ClO2,反应的化学方程式为_____________。
(2)装置A和E的作用是__________。
(3)装置D中发生反应的化学方程式为____________。
(4)反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,然后进行的操作是_______,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体。
实验Ⅱ 丙同学设计实验测定制得NaClO2样品的纯度
其实验步骤如下:
① 称取所得亚氯酸钠样品ag于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应后,配成100mL混合液。
② 取25.00 mL待测液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,消耗标准液体积的平均值为VmL(已知:I2+2S2O32-=2I-+S4O62-)。
(5)步骤① 反应的离子方程式为______________。
(6)步骤② 滴定中使用的指示剂是_________。
(7)样品中NaClO2的质最分数为_______(用含a、b、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存,加入OH-有沉淀析出,加入H+能放出气体的离子组是
A.Mg2+、Na+、Cl-、CO32- B.Ba2+、K+、OH-、NO3-
C.H+、Fe3+、NH4+、SO42- D.Na+、Ca2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是自来水表的常见安装方式。下列有关说法不正确的是( )

A. 发生腐蚀过程中,电子从接头流向水表
B. 腐蚀时,铁接头发生的是还原反应
C. 腐蚀时铜质水表发生的电极反应为:2H2O+O2+4e—=4OH—
D. 腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮和含硫化合物的性质在工业生产和环境保护中有重要意义。
(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g) △H=-198kJ·mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) △H=-41.8kJ·mol-1
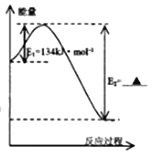
若CO的燃烧热为283 kJ·mol-1,则1molNO2和1mol CO 反应生成CO2和NO的能量变化示意图中E2= _________kJ·mol-1
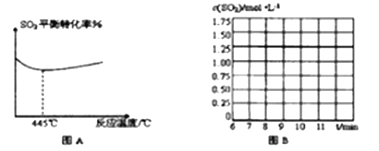
(2)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g)![]() S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
②第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,在10分钟时达到平衡,CO的物质的量变化了1mol。请在图B中画出SO2浓度从6~11分钟的变化曲线。
(3)己知某温度下,H2SO3的电离常数为K1≈l.5×10-2, K2≈1.0×10-7,用NaOH溶液吸收SO2,当溶液中HSO3-, SO32-离子相等时,溶液的pH值约为_________
(4)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为_________,连二亚硫酸根与HNO2反应的离子方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com