
【题目】下表是元素周期表的一部分,回答下列问题:
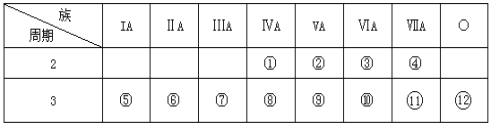
(1)写出①、②两种元素的名称______ ,______。
(2)这些元素的最高价氧化物的对应水化物中________碱性最强;能形成两性氢氧化物的元素是________。
(3)比较⑤与⑥的化学性质,________更活泼,试用实验证明此现象(简述操作、现象和结论) _______。
【答案】碳 氮 NaOH Al 钠 金属钠和金属镁的单质分别与冷水反应,反应剧烈程度大的是钠,反之是镁
【解析】
首先根据元素在周期表中的位置判断出元素,然后结合元素周期律以及相关物质的性质分析解答。
根据元素在周期表中的相对位置可知①~分别是C、N、O、F、Na、Mg、Al、Si、P、S、Cl、Ar。则
(1)①、②两种元素的名称分别是碳、氮。
(2)金属性越强,最高价氧化物的对应水化物的碱性越强,则这些元素的最高价氧化物的对应水化物中NaOH碱性最强;氢氧化铝是两性氢氧化物,因此能形成两性氢氧化物的元素是Al。
(3)同周期自左向右金属性逐渐减弱,则钠比镁更活泼,可依据二者的单质分别与水反应的剧烈程度判断其金属性强弱,金属钠和金属镁的单质分别与冷水反应,反应剧烈程度大的是钠,反之是镁。


科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____(填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO、OH、FeO42-、Cl、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________。
②每生成1molFeO42-转移________mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I===2Fe2++I2,2Fe2++Br2===2Fe3++2Br,2Fe2++Cl2===2Fe3++2Cl
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br被氧化一半时,c为_______________(用含a、b的代数式表示)。
(3)已知:S2O![]() 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
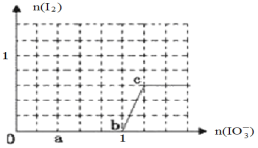
写出a点处还原产物是_______________;b点到c点反应的离子方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
以下为废水中铬元素总浓度的测定方法:_______________________
准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O
③I2+2S2O32-===2I-+S4O62-
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3·5H2O)纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为:2S2O32-+I2===S4O62-+2I-

①滴定至终点时,溶液颜色的变化:________。
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | H2O | 电石 | KMnO4 | 乙炔具有还原性 | |
D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或溶液)的转化关系,已知单质B2、C2、D2、E2在常温常压下都是气体,化合物G的焰色反应为黄色;化合物I、J、K通常状况下呈气态。下列说法正确的是
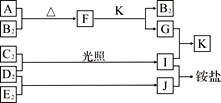
A. B氢化物的沸点高于其同主族其它元素氢化物的沸点
B. 原子半径大小:A>C>B>E>D
C. F中既含有离子键又含有极性共价键
D. G中的阴离子能抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)表中元素原子半径最大的是(写元素符号)__________,Z原子核外电子能量最高的电子亚层是__________。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:_________________;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因______________________________________________________。
(4)硫酸工业生产中接触室内发生的反应方程式为______________________________________;
在实际生产中,操作温度选定400—500℃、压强通常采用常压的原因分别是__________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A. 硅是非金属元素,它的单质是灰黑色有金属光泽的固体
B. 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C. 硅的化学性质不活泼,常温下不与任何物质反应
D. 粗硅的冶炼反应,体现了高温下SiO2的弱氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com