
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1
(2)C(s)+O2(g)=CO2(g)△H2
(3)2H2(g)+O2(g)=2H2O(l)△H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l)△H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H5
下列关于上述反应的焓变的判断正确的是( )
A.△H1>0,△H2<0 B.△H5=2△H2+△H3﹣△H1
C.△H3>0,△H5<0 D.△H4=△H1﹣2△H3
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
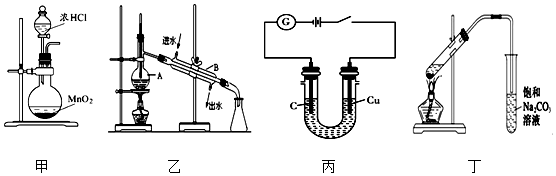
| A. | 利用装置甲制取氯气 | |
| B. | 利用装置乙分离乙酸(沸点:118℃)与乙酸乙酯(沸点:77.1℃) | |
| C. | 利用装置丙可电解食盐水制氯气和氢气 | |
| D. | 利用装置丁制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
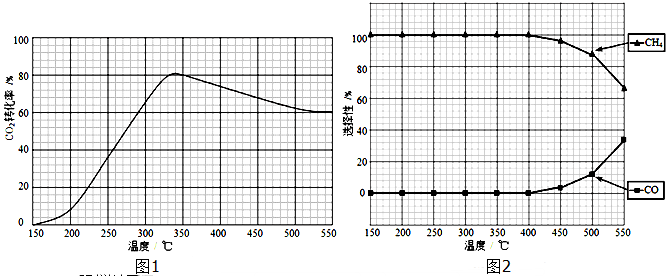
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
一定条件下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s) + CO2(g) FeO(s) + CO(g) ΔH>0。反应过程中CO2气体和CO气体的浓度与时间的关系如下图所示:
FeO(s) + CO(g) ΔH>0。反应过程中CO2气体和CO气体的浓度与时间的关系如下图所示:
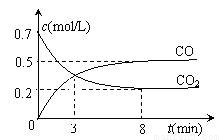
下列说法不正确的是
A.该反应的平衡常数表达式为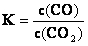
B.升高温度后达新平衡时,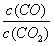 增大
增大
C.3分钟时,CO和CO2的浓度相等,反应达到平衡状态
D.8分钟内CO的平均反应速率v(CO)= 0.0625 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
某探究小组研究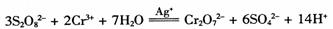 的反应速率与浓度的关系。反应速率v(Cr3+)可通过测定c(Cr3+)减半所需时间来确定。在一定温度下,获得如下实验数据:
的反应速率与浓度的关系。反应速率v(Cr3+)可通过测定c(Cr3+)减半所需时间来确定。在一定温度下,获得如下实验数据:
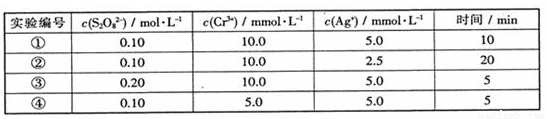
分析以上数据所得出的结论不正确的是
A、增大c(Ag+),v(Cr3+)增大
B、实验②的v(Cr3+)为0.25mmol•L-1•min-1
C、增大c(S2O82-),v(Cr3+)增大
D、增大c(Ag+),v(Cr3+)不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
工业生产水煤气的反应为:C(s)+H2O(g)→C O(g)+H2(g) △H=+131.4 kJ/mol下列判断正确的是
O(g)+H2(g) △H=+131.4 kJ/mol下列判断正确的是
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)→C(s)+H2O(g) △H=-131.4 kJ/mol
C.水煤气反应中生成1 g H2(g)吸收131.4 KJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 KJ热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:选择题
下列说法错 误的是
误的是
A.58.5g NaCl溶于1L水中配得1mol/L NaCl溶液
B.在标准状况下,44.8LHCl气体溶于水配成1L溶液,所得溶 液中溶质的物质的量浓度为2mol/L。
液中溶质的物质的量浓度为2mol/L。
C.在标准状况下,22.4L氨气溶于水配成1L溶液,从所得溶液中取出10mL,其物质的量浓度为1mol/L。
D.1mol/L的CaCl2溶液1L,取出100mL,含0.2molCl-。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
瑞典皇家科学院曾将诺贝尔化学奖授予“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家。下列分子中含有“手性碳原子”的是
A.CBr2F2 B.CH3CH(OH)COOH C.CH3CH2CH3 D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com