
”¾ĢāÄæ”æŅŌijŗ¬ĶæóŹÆ[Ö÷ŅŖ³É·ÖŹĒFeCuSi3O13(OH)4£¬ŗ¬ÉŁĮæSiO2”¢CaCO3]ĪŖŌĮĻÖʱøCuSO4”¤5H2OµÄĮ÷³ĢČēĻĀ£ŗ

ŅŃÖŖĻą¹ŲŹŌ¼Į³É·ÖŗĶ¼ŪøńČēĻĀ±ķĖłŹ¾£ŗ

Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŗ¬ĶæóŹÆ·ŪĖéµÄÄæµÄŹĒ_______”£
£Ø2£©Ėį½žŗóµÄČÜŅŗÖŠ³żĮĖCu2+Ķā£¬»¹ŗ¬ÓŠµÄ½šŹōŃōĄė×ÓŹĒ_______”£
£Ø3£©¹ĢĢå1ČÜÓŚNaOHČÜŅŗµÄĄė×Ó·½³ĢŹ½ĪŖ__________”£
£Ø4£©½įŗĻĢāÖŠŠÅĻ¢æÉÖŖ£ŗĖłŃ”ÓƵďŌ¼Į1µÄĆū³ĘĪŖ_______£»¼ÓČėøĆŹŌ¼ĮŹ±£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_________”£
£Ø5£©ŹŌ¼Į2 æÉŅŌŃ”ŌńĻĀĮŠĪļ³ÉÖŠµÄ______”£ĀĖŌü2ÖŠŅ»¶Øŗ¬ÓŠµÄĪļÖŹĪŖ______(Ģī»ÆѧŹ½£©”£
A. Cu B.CuO C.Cu(OH)2 D.Fe
£Ø6£©CuSO4”¤5H2OÓĆÓŚµē½ā¾«Į¶ĶŹ±£¬µ¼ĻßÖŠĶعż9.632”Į103CµÄµēĮ棬²āµĆŃō¼«ČܽāµÄĶĪŖ16.0g”£¶ųµē½āÖŹČÜŅŗ£ØŌČÜŅŗĪŖ1 L£©ÖŠĒ”ŗĆĪŽCuSO4£¬ŌņĄķĀŪÉĻŅõ¼«ÖŹĮæŌö¼Ó_____g£¬Ōµē½āŅŗÖŠCuSO4µÄÅضČĪŖ__ ”£ŅŃÖŖŅ»øöµē×ӵĵēĮæĪŖ1.6”Į10-19C£©
”¾“š°ø”æ Ģįøßŗ¬ĶæóŹÆµÄĄūÓĆĀŹ¼°Ėį½žŠ§ĀŹ Fe2+ SiO2+2OH-=SiO32-+H2O ĘÆŅŗ ClO-+2Fe2++2H+=Cl-+2Fe3++H2O BC Fe(OH)3 32.0 0.25mol/L
”¾½āĪö”ææóŹÆ·ŪĖéŗóÓė×ćĮæĻ”ĮņĖį·“Ó¦Ģś”¢Ķ¾ł×Ŗ»ÆĪŖĮņĖįŃĪ£¬¶žŃõ»Æ¹čŗĶĢ¼ĖįøʱäĪŖĀĖŌü1£¬¶žÕßŌŚøßĪĀĻĀ·“Ó¦×Ŗ»ÆĪŖ¹čĖįøĘ£»ŅŖµĆµ½ĮņĖįĶ¾§ĢåŠčŅŖ³żČ„ČÜŅŗÖŠµÄŃĒĢśĄė×Ó£¬ĄūÓĆŃĒĢśĄė×ӵĻ¹ŌŠŌ¼ÓČėŃõ»Æ¼Į×Ŗ»ÆĪŖĢśĄė×Ó£¬Ķعżµ÷½ŚpH×Ŗ»ÆĪŖĒāŃõ»ÆĢś³Įµķ£¬¹żĀĖ¼“µĆµ½ĮņĖįĶČÜŅŗ£¬¾Ż“Ė·ÖĪö½ā“š”£
£Ø1£©ŗ¬ĶæóŹÆ·ŪĖéæÉŅŌŌö“ó·“Ó¦ĪļµÄ½Ó“„Ć껿£¬¼Óæģ·“Ó¦ĖŁĀŹ£¬¼“ÄæµÄŹĒĢįøßŗ¬ĶæóŹÆµÄĄūÓĆĀŹ¼°Ėį½žŠ§ĀŹ£»£Ø2£©øł¾ŻÕżøŗ¼Ū“śŹżŗĶĪŖ0æÉÖŖFeCuSi3O6(OH)4ÖŠĢśŌŖĖŲµÄ»ÆŗĻ¼ŪŹĒ£«2¼Ū£¬Ņņ“ĖĖį½žŗóµÄČÜŅŗÖŠ³żĮĖCu2+Ķā£¬»¹ŗ¬ÓŠµÄ½šŹōŃōĄė×ÓŹĒFe2+£»£Ø3£©¹ĢĢå1ÖŠŗ¬ÓŠ¶žŃõ»Æ¹č£¬ČÜÓŚNaOHČÜŅŗµÄĄė×Ó·½³ĢŹ½ĪŖSiO2+2OH-=SiO32-+H2O£»£Ø4£©½įŗĻĢāÖŠŠÅĻ¢æÉÖŖĘÆŅŗµÄ¼Ūøń×ī¾¼Ć£¬Ņņ“ĖĖłŃ”ÓƵďŌ¼Į1µÄĆū³ĘĪŖĘÆŅŗ£¬¼ÓČėøĆŹŌ¼ĮŹ±øł¾Żµē×ӵƏ§ŹŲŗćŗĶŌ×ÓŹŲŗćæÉÖŖ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖClO-+2Fe2++2H+=Cl-+2Fe3++H2O£»£Ø5£©ŹŌ¼Į2ŹĒĪŖĮĖµ÷½ŚpH³ĮµķĢśĄė×Ó£¬µĆµ½“æ¾»µÄĮņĖįĶČÜŅŗ£¬Ņņ“ĖæÉŅŌŃ”ŌńŃõ»ÆĶ»ņĒāŃõ»ÆĶ£¬“š°øŃ”BC£»ĀĖŌü2ÖŠŅ»¶Øŗ¬ÓŠµÄĪļÖŹĪŖFe(OH)3£»£Ø6£©Ķعżµē×ÓµÄøöŹżŹĒ9.632”Į104C”Ā1.6”Į10-19C£½6.02”Į1023£¬ĪļÖŹµÄĮæŹĒ1mol”£øł¾ŻCu2£«£«2e££½CuæÉÖŖĄķĀŪÉĻŅõ¼«ÖŹĮæŌö¼Ó![]() ”£Ńō¼«ČܽāµÄĶŹĒ16g”Ā64g/mol£½0.25mol£¬ĖłŅŌČÜŅŗÖŠĮņĖįĶµÄĪļÖŹµÄĮæŹĒ0.5mol-0.25mol=0.25mol£¬ŌņÅØ¶ČŹĒ0.25mol”Ā1L£½0.25mol/L”£
”£Ńō¼«ČܽāµÄĶŹĒ16g”Ā64g/mol£½0.25mol£¬ĖłŅŌČÜŅŗÖŠĮņĖįĶµÄĪļÖŹµÄĮæŹĒ0.5mol-0.25mol=0.25mol£¬ŌņÅØ¶ČŹĒ0.25mol”Ā1L£½0.25mol/L”£


 æŚĖćÄÜŹÖĻµĮŠ“š°ø
æŚĖćÄÜŹÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)½«ŠæʬŗĶŅųʬ½žČėĻ”ĮņĖįÖŠ×é³ÉŌµē³Ų£¬Į½µē¼«¼äĮ¬½ÓŅ»øöµēĮ÷±ķ”£
ŠæʬÉĻ·¢ÉśµÄµē¼«·“Ó¦£ŗ__________________£»ŅųʬÉĻ·¢ÉśµÄµē¼«·“Ó¦£ŗ_________________”£
(2)ČōøƵē³ŲÖŠĮ½µē¼«µÄ×ÜÖŹĮæĪŖ60 g£¬¹¤×÷Ņ»¶ĪŹ±¼äŗó£¬Č”³öŠæʬŗĶŅųʬĻ“¾»øÉŌļŗó³ĘÖŲ£¬×ÜÖŹĮæĪŖ47 g£¬ŹŌ¼ĘĖć£ŗ
¢Ł²śÉśĒāĘųµÄĢå»ż(±ź×¼×“æö)___________L£»
¢ŚĶعżµ¼ĻߵĵēĮæ________C”£(ŅŃÖŖNA£½6.02”Į1023mol£1£¬µē×ÓµēŗÉĪŖ1.60”Į10£19C)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫10 mL 5 mol£ÆLµÄHClČÜŅŗĻ”ŹĶµ½200 mL£¬“ÓÖŠČ”³ö5 mL£¬Õā5 mLČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ£Ø””””£©
A. 0.5 mol£ÆL B. 0.25 mol£ÆL C. 0.1 mol£ÆL D. 1 mol£ÆL
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æK2Cr2O7ČÜŅŗÖŠ“ęŌŚĘ½ŗā£ŗCr2O72-(³ČÉ«)+H2O![]() 2CrO42-(»ĘÉ«)+2H+”£ÓĆK2Cr2O7ČÜŅŗ½ųŠŠĻĀĮŠŹµŃé£ŗ
2CrO42-(»ĘÉ«)+2H+”£ÓĆK2Cr2O7ČÜŅŗ½ųŠŠĻĀĮŠŹµŃé£ŗ

½įŗĻŹµŃ飬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. ¢ŁÖŠČÜŅŗ³ČÉ«¼ÓÉī£¬¢ŪÖŠČÜŅŗ±ä»Ę
B. ¢ŚÖŠCr2O72-±»C2H5OH»¹Ō
C. ¶Ō±Č¢ŚŗĶ¢ÜæÉÖŖK2Cr2O7ĖįŠŌČÜŅŗŃõ»ÆŠŌĒæ
D. ČōĻņ¢ÜÖŠ¼ÓČė70%H2SO4ČÜŅŗÖĮ¹żĮ棬ČÜŅŗ±äĪŖ³ČÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņ1 Lŗ¬0.01 mol NaAlO2ŗĶ0.02 mol NaOHµÄČÜŅŗÖŠ»ŗĀżĶØČėCO2£¬Ėęn(CO2)Ōö“ó£¬ĻČŗó·¢ÉśČżøö²»Ķ¬µÄ·“Ó¦£¬µ±0.01 mol<n(CO2)![]() 0.015Ź±·¢ÉśµÄ·“Ó¦ŹĒ£ŗ2NaAlO2+ CO2+3H2O=2Al(OH)3”ż+Na2CO3”£ĻĀĮŠ¶ŌÓ¦¹ŲĻµÕżČ·µÄŹĒ
0.015Ź±·¢ÉśµÄ·“Ó¦ŹĒ£ŗ2NaAlO2+ CO2+3H2O=2Al(OH)3”ż+Na2CO3”£ĻĀĮŠ¶ŌÓ¦¹ŲĻµÕżČ·µÄŹĒ
Ń”Ļī | n(CO2)/mol | ČÜŅŗÖŠĄė×ÓµÄĪļÖŹµÄĮæÅØ¶Č |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)>c(HCO3-)> c(OH-)>c(H+) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫MgŗĶCuµÄŗĻ½š2.64æĖ£¬Ķ¶ČėŹŹĮæµÄĻ”HNO3ÖŠĒ”ŗĆ·“Ó¦£¬¹ĢĢåČ«²æČܽāŹ±£¬ŹÕ¼ÆµÄ»¹Ō²śĪļĪŖNO£¬Ģå»żĪŖ0.896L (SPt)£¬Ļņ·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČė2mol/L NaOHČÜŅŗ60mLŹ±£¬½šŹōĄė×ÓĒ”ŗĆĶźČ«³Įµķ£¬ŌņŠĪ³É³ĮµķµÄÖŹĮæĪŖ
A. 4.32æĖ B. 4.68æĖ C. 5.36æĖ D. 6.38æĖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒāäåĖįŌŚŅ½Ņ©ŗĶŹÆ»Æ¹¤ŅµÉĻÓŠ¹ć·ŗÓĆĶ¾”£ĻĀĶ¼ŹĒÄ£Äā¹¤ŅµÖʱøĒāäåĖį“ÖĘ·²¢¾«ÖʵÄĮ÷³Ģ”£
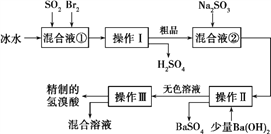
øł¾ŻÉĻŹöĮ÷³Ģ»Ų“šĻĀĮŠĪŹĢā:
£Ø1£©»ģŗĻŅŗ¢ŁÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ________________________”£
£Ø2£©äåÓėĀČ½įŗĻŠĪ³ÉBrCl,BrClµÄŠŌÖŹÓėĀ±ĖŲµ„ÖŹĻąĖĘ”£ŌņBrClÓėĖ®·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________________”£
£Ø3£©¼ÓČėBa(OH)2·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ______________²Ł×÷¢ņµÄĆū³ĘŹĒ______”£²Ł×÷¢óŅ»°ćŹŹÓĆÓŚ·ÖĄė______»ģŗĻĪļ”£(Ń”Ģī±ąŗÅ)
a£®¹ĢĢåŗĶŅŗĢå b£®¹ĢĢåŗĶ¹ĢĢå c£®»„²»ĻąČܵÄŅŗĢå d£®»„ČܵÄŅŗĢå
£Ø4£©“æ¾»µÄĒāäåĖįÓ¦ĪŖĪŽÉ«ŅŗĢ壬µ«Źµ¼Ź¹¤ŅµÉś²śÖŠÖʵƵÄĒāäåĖį(¹¤ŅµĒāäåĖį)³£“ųÓŠµµµÄ»ĘÉ«”£ÓŚŹĒ¼×”¢ŅŅĮ½Ķ¬Ń§Éč¼ĘĮĖ¼ņµ„ŹµŃé¼ÓŅŌĢ½¾æ£ŗ¼×Ķ¬Ń§¼ŁÉč¹¤ŅµĒāäåĖį³Źµ»ĘÉ«ŹĒŅņĪŖŗ¬ÓŠF![]() ,ŌņÓĆÓŚÖ¤Ć÷øĆ¼ŁÉčĖłÓƵďŌ¼ĮĪŖ______£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________”£
,ŌņÓĆÓŚÖ¤Ć÷øĆ¼ŁÉčĖłÓƵďŌ¼ĮĪŖ______£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀ£¬CH4ÓėH2O(g)·¢Éś·“Ó¦£ŗCH4(g)+H2O(g)![]() CO(g)+3H2(g)£¬ÉčĘšŹ¼
CO(g)+3H2(g)£¬ÉčĘšŹ¼![]() =Z£¬ŌŚŗćŃ¹ĻĀ£¬Ę½ŗāŹ±
=Z£¬ŌŚŗćŃ¹ĻĀ£¬Ę½ŗāŹ±![]() (CH4)µÄĢå»ż·ÖŹżÓėZŗĶT(ĪĀ¶Č)µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
(CH4)µÄĢå»ż·ÖŹżÓėZŗĶT(ĪĀ¶Č)µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A£®øĆ·“Ó¦µÄģŹ±ä¦¤H>0
B£®Ķ¼ÖŠZµÄ“óŠ”ĪŖa>3>b
C£®Ķ¼ÖŠXµć¶ŌÓ¦µÄĘ½ŗā»ģŗĻĪļÖŠ![]() =3
=3
D£®ĪĀ¶Č²»±äŹ±£¬Ķ¼ÖŠXµć¶ŌÓ¦µÄĘ½ŗāŌŚ¼ÓŃ¹ŗó![]() (CH4)¼õŠ”
(CH4)¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½ŗĢåĒų±šÓŚĘäĖü·ÖÉ¢ĻµµÄ±¾ÖŹĢŲÕ÷ŹĒ£Ø £©
A.½ŗĢåŹĒŅ»ÖÖ½éĪČŠŌµÄ·ÖÉ¢Ļµ
B.½ŗĢåĮ£×Ó“ųµēŗÉ
C.½ŗĢåĮ£×ÓÖ±¾¶ŌŚ1©100nmÖ®¼ä
D.¹āŹųĶعż½ŗĢåŹ±ÓŠ¶”“ļ¶ūŠ§Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com